微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铜、铁、钒都是日常生活中常见的金属,具有广泛用途。请回答:
(1)在元素周期表中,铜元素位于____区,其基态原子的电子排布式为????????。
(2)Cu2O的熔点比Cu2S高,原因为???????????????????????。
(3)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂。
①写出CO的一种常见等电子体分子的结构式____;两者相比较沸点高的为??????(填分子式)。
②Fe(CO)5在一定条件下发生反应:Fe(CO)5(s)=Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的化学键类型为????????。
(4)已知AlCl3·NH3和AlCl4—中均有配位键。AlCl3·NH3中,提供空轨道的原于是____;在AlCl4中Al原子的杂化轨道类型为???????????。
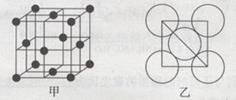
(5)金属铝的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示。则晶体铝中原子的堆积方式为____。已知:铝原子半径为d cm,摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=???????????。
参考答案:(1)ds? 1s22 s22p63 s23 p63d104
本题解析:
试题分析:(1)29号元素Cu在元素周期表中位于第四周期第IB族。因此属于ds区。其基态原子的电子排布式为1s22 s22p63 s23 p63d104s1或[Ar]3d104s1。(2)Cu2O的熔点比Cu2S高,是因为Cu2O与Cu2S都属于离子晶体。其阳离子相同、阴离子所带的电荷也相同,但由于氧离子的半径小于硫离子的离子半径,Cu2O的晶格能更大,断裂其离子键需要消耗的能量更高,所以Cu2O的熔点比Cu2S的高。(3) ①CO的一种常见等电子体是N2。分子的结构式N≡N。CO与N2两者相对分
本题难度:困难
2、选择题 下列物质中,只含有离子键的化合物是( )
A.NaOH
B.MgCl2
C.KBr
D.H2O
参考答案:BC
本题解析:
本题难度:简单
3、选择题 下列物质中含有非极性键的分子是( )
A.Na2O2
B.CH4
C.N2
D.CO2
参考答案:C
本题解析:
本题难度:一般
4、选择题 物质的下列性质属于物理性质的是( )
A.氧气能转化成臭氧
B.食盐水能导电
C.钠能浮在水面上
D.钾能溶于酒精
参考答案:A、氧气能转化成臭氧要通过化学变化表现出来,属于化学性质,故
本题解析:
本题难度:简单
5、选择题 已知主族元素A和B的原子序数分别为a和b,且原子半径为B>A,则下列说法中正确的是( )
A.a一定大于b
B.若A和B不在同一周期,则a一定大于b
C.a一定小于b
D.若A和B在同一周期,a一定大于b
参考答案:若元素A、B同周期,同一周期,随原子序数递增,原子半径逐渐减
本题解析:
本题难度:一般