微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6。含有MgCO3沉淀的MgCl2溶液中,已知c(Mg2+)="0.2" mol/L。如果加入等体积的CaCl2溶液,若要产生CaCO3沉淀,加入CaCl2溶液的物质的量浓度最小约为
A.7.27×10-5mol/L
B.1.45×10-4mol/L
C.2.9×10-4mol/L
D.5.8×10-4mol/L
参考答案:B
本题解析:
试题解析:两溶液等体积混合,所以MgCl2溶液中c(Mg2+)="0.1" mol/L,利用Ksp(MgCO3)=c(Mg2+)×c(CO32-)=6.82×10-6,解得c(CO32-)=6.82×10-5mol/L ,再根据Ksp(CaCO3)=c(Ca2+)×c(CO32-)=4.96×10-9,解得c(Ca2+)=7.27×10-5mol/L,则原溶液中c(Ca2+)=2×7.27×10-5mol/L=1.45×10-4mol/L ,故B正确。
考点:Ksp的应用
本题难度:一般
2、填空题 茶是我国人民喜爱的饮品。我市某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。
【查阅部分资料】草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH为Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。

请根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 。
(2)写出检验Ca2+的离子方程式 。
(3)写出沉淀C所含主要物质的化学式 。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式 。
(5)步骤⑨的作用是 。
(6)称取400g茶叶样品灼烧得灰粉后,加入过量盐酸后过滤,将所得滤液加入过量的(NH4)2C2O4溶液,再过滤、洗涤、干燥、称量得到5.12g沉淀,原茶叶中钙元素的质量分数为 。
参考答案:(1)使Ca2+、Al3+、Fe3+浸出(或使Ca2+、Al
本题解析:
试题分析:(1)茶叶中含有的物质有盐、碱等可溶性的物质,步骤②加盐酸的作用是使Ca2+、Al3+、Fe3+变为离子进入溶液而浸出;(2)若溶液中存在Ca2+,加入草酸铵[(NH4)2C2O4],会产生白色沉淀,反应的离子方程式是Ca2++(NH4)2C2O4===CaC2O4↓+2NH4+;(3)向茶叶灼烧后的灰烬中加入盐酸,金属变为可溶性盐存在于溶液中,向其中加入浓氨水,调节溶液的pH在6~7,根据金属氢氧化物形成沉淀的pH可知溶液中的Al3+、Fe3+会变为Al(OH)3、Fe(OH)3沉淀析出,所以沉淀C所含主要物质的化学式是Al(OH)3、Fe(OH)3;(4) 将含有沉淀Al(OH)3、Fe(OH)3的物质分为2份,向其中的一份中加入盐酸溶解得到FeCl3、AlCl3溶液,向该溶液中加入KSCN溶液,发生反应:FeCl3+3KSCN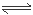 Fe(SCN)3+3KCl,溶液变为血红色,所以步骤⑧用A试剂是KSCN溶液,生成红色溶液的离子方程式是Fe3++3SCN-
Fe(SCN)3+3KCl,溶液变为血红色,所以步骤⑧用A试剂是KSCN溶液,生成红色溶液的离子方程式是Fe3++3SCN-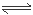 Fe(SCN)3;(5)向另一份溶液中加入足量的NaOH溶液,发生反应:Al3++4OH-= AlO2-+ 2H2O ;Fe3++3OH-= Fe(OH)3↓,沉淀是Fe(OH)3,溶液中含有NaAlO2、NaCl、NaOH,步骤⑨的作用是使Fe3+转化为Fe(OH)3沉淀;(6) 该溶液含有的沉淀是CaC2O4,根据离子方程式Ca2++(NH4)2C2O4===CaC2O4↓+2NH4+,可知n(Ca2+)=n(CaC2O4)= 5.12g÷128g/mol=0.04mol,所以m(Ca2+)=" 0.04mol×40g/mol=1.6g," 原茶叶中钙元素的质量分数为(1.6g÷400g) ×100%=0.4%。
Fe(SCN)3;(5)向另一份溶液中加入足量的NaOH溶液,发生反应:Al3++4OH-= AlO2-+ 2H2O ;Fe3++3OH-= Fe(OH)3↓,沉淀是Fe(OH)3,溶液中含有NaAlO2、NaCl、NaOH,步骤⑨的作用是使Fe3+转化为Fe(OH)3沉淀;(6) 该溶液含有的沉淀是CaC2O4,根据离子方程式Ca2++(NH4)2C2O4===CaC2O4↓+2NH4+,可知n(Ca2+)=n(CaC2O4)= 5.12g÷128g/mol=0.04mol,所以m(Ca2+)=" 0.04mol×40g/mol=1.6g," 原茶叶中钙元素的质量分数为(1.6g÷400g) ×100%=0.4%。
考点:考查化学操作的目的、反应条件的控制、物质成分的确定、离子方程式的书写及守恒方法在物质中元素含量的计算的知识。
本题难度:困难
3、填空题 镁、铝、铁及其化合物在生产、生活中有着广泛的应用
I:实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
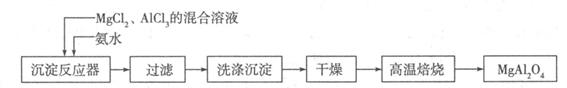
(1)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34,该温度下向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成 沉淀(填化学式)。
(2)高温焙烧时发生反应的化学方程式 ,洗涤沉淀时的方法是 。
(3)常温下如果向AlCl3饱和溶液中不断通人HCl气体,可析出AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
Ⅱ:某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
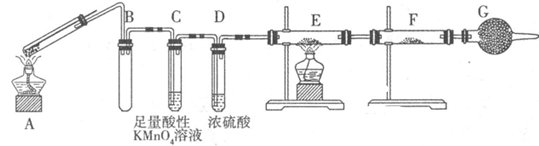
(1)G装置的作用是 。
(2)证明有SO2生成的现象是 ,为了证明气体中含有氢气,装置E和F中加入的试剂分别为 、 。
(3)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是 。
参考答案:I(1)Al(OH)3
(2)2Al(OH)3+Mg(
本题解析:
试题分析:I(1)根据Ksp[Mg(OH)2]可求出Mg2+再转化为Mg(OH)2沉淀OH?浓度,c(Mg2+)?c2(OH?)=1.8×10-11,因为c(Mg2+)=1/2c(OH?),则1/2c3(OH?)=1.8×10-11, Ksp[Al(OH)3]="1/3" c4(OH?)=3×10-34,比较可得恰好生成Al(OH)3时,OH?浓度小,所以先生成Al(OH)3沉淀。
(2)根据流程图,高温焙烧时的反应物为Mg(OH)2和Al(OH)3,生成物为MgAl2O4和4H2O,配平可得化学方程式:2Al(OH)3+Mg(OH)2=MgAl2O4+4H2O;沉淀洗涤的方法为:向置于过滤器上的沉淀加蒸馏水至完全没过沉淀,待其自然流尽后,重复二到三次即可。
(3)AlCl3饱和溶液中存在沉淀溶解平衡:AlCl3?6H2O(s)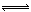 Al3+(aq)+3Cl?(aq)+6H2O(l),通入HCl气体使溶液中c(Cl?)增大,平衡向析出固体的方向移动从而析出AlCl3?6H2O晶体。
Al3+(aq)+3Cl?(aq)+6H2O(l),通入HCl气体使溶液中c(Cl?)增大,平衡向析出固体的方向移动从而析出AlCl3?6H2O晶体。
II(1)因为该实验要检验是否有H2O生成,所以装置G盛放物质为碱石灰,作用是防止空气中的H2O进入F。
(2)SO2具有还原性,能被酸性KMnO4溶液氧化,所以证明有SO2生成的现象是酸性高锰酸钾溶液褪色;为了证明气体中含有氢气,装置E和F中加入的试剂分别为CuO、CuSO4,若含有H2,H2可把CuO还原为Cu,生成的H2O能与CuSO4反应生成蓝色的CuSO4?5H2O。
(3)浓硫酸中的水很少,CuSO4没有溶解,以CuSO4固体的形式存在,为白色。
考点:本题考查化学流程的分析、化学方程式的书写、沉淀溶解平衡、化学实验方案的分析。
本题难度:困难
4、填空题 (8分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法?
该法的工艺流程为??

其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显????色。
(2)能说明第①步反应达平衡状态的是??????????。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)??
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至??????????。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。?
(4)用Fe做电极的原因为????????????????????????????????。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) ???????????????????????????。
溶液中同时生成的沉淀还有???????????????????????。
参考答案:
 本题解析:(1)平衡体系的pH=2,即溶液为酸性溶液,则溶液显橙色;
本题解析:(1)平衡体系的pH=2,即溶液为酸性溶液,则溶液显橙色;
(2)能说明第①步反应达平衡状态的是:溶液的颜色不变即各组分的浓度保持不变的状态;
(3)由Ksp=c(Cr3+)?c3(OH-)=10-32,可得,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
(4)用Fe做电极的原因为:Fe为阳极,发生氧化反应,生成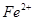 本题难度:一般
本题难度:一般
5、选择题 14.向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag+ + 2NH3·H2O 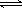 Ag(NH3+)2+ 2H2O。下列分析不正确的是
Ag(NH3+)2+ 2H2O。下列分析不正确的是
A.浊液中存在沉淀溶解平衡:AgCl (s) 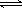 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
B.实验可以证明NH3结合Ag+能力比Cl-强
C.实验表明实验室可用氨水洗涤银镜反应后的试管
D.由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
参考答案:C
本题解析:
试题分析:氯化银为常见的难溶物,存在的溶解平衡为AgCl (s) 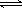 Ag+(aq)+Cl-(aq);向AgCl浊液中滴加氨水后,沉淀溶解,得到澄清溶液,继续滴加浓硝酸后又有沉淀生成,又Ag+ + 2NH3·H2O
Ag+(aq)+Cl-(aq);向AgCl浊液中滴加氨水后,沉淀溶解,得到澄清溶液,继续滴加浓硝酸后又有沉淀生成,又Ag+ + 2NH3·H2O 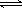 Ag(NH3+)2+ 2H2O,可知NH3结合Ag+能力比Cl-强;实验室做完银镜反应的试验后,可用稀硝酸洗涤银镜反应后的试管;AgCl浊液中加氨水,形成了银氨溶液,加入浓硝酸后,浓硝酸与氨水反应,最终得到的物质为AgCl。
Ag(NH3+)2+ 2H2O,可知NH3结合Ag+能力比Cl-强;实验室做完银镜反应的试验后,可用稀硝酸洗涤银镜反应后的试管;AgCl浊液中加氨水,形成了银氨溶液,加入浓硝酸后,浓硝酸与氨水反应,最终得到的物质为AgCl。
考点:难溶物的溶解平衡
点评:本题主要考查了难溶物的溶解平衡,关键是要掌握难溶物的溶解平衡的原理,本题稍有难度。
本题难度:一般