微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 过氧化氢(H2O2)俗名双氧水,医疗上可做外科消毒剂。
(1)H2O2的电子式为______。
(2)将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫色消褪了,此时双氧水表现出_______性。若MnO4-的产物为Mn2+,该反应的离子方程式为______。
(3)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关的反应方程式为______。此时双氧水表现出______性。
参考答案:(1)?? 本题解析:H2O2中氧为-1价,处于0价与-2价之间,所以H2O2既有氧化性,又有还原性。因-1价不稳定,倾向于再得一个电子变成-2价氧,所以H2O2主要的性质是强氧化性。这是过氧化物的基本性质。
本题解析:H2O2中氧为-1价,处于0价与-2价之间,所以H2O2既有氧化性,又有还原性。因-1价不稳定,倾向于再得一个电子变成-2价氧,所以H2O2主要的性质是强氧化性。这是过氧化物的基本性质。
本题难度:一般
2、填空题 请回答下列化工生产中的一些问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在???????的郊区(填标号)。
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为?????????????????????????????????????????????????????????。
(3)为提高SO3吸收率,实际生产中通常用?????????????????吸收SO3。
(4)已知反应2SO2(g)+O2(g)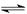 2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为?????????;该条件下的平衡常数为???????????????。
2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为?????????;该条件下的平衡常数为???????????????。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃
| 600
| 620
| 640
|
炉渣中CuSO4的质量数/%
| 9.3
| 9.2
| 9.0
?
已知CuSO4在低于660 ℃时不会分解,请简要分析上表中CuSO4 的质量分数随温度升高而降低的原因???????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用?????????(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式???????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????。
参考答案:(1)C
(2)4CuFeS2+13O2![]()
本题解析:(1)硫酸具有很强的腐蚀性,运输成本较高,故硫酸厂厂址应靠近硫酸消费中心;(2)由题意可知,反应物为CuFeS2和O2,产物为CuO、Fe2O3和SO2,配平即可;(3)SO3与水反应放出大量的热,易形成酸雾,影响SO3的吸收,故用水吸收的效率很低,而用98%的浓硫酸则可避免酸雾的形成,达到较高的吸收率;(4)设平衡时反应的O2的物质的量为x,可得反应的三段式:
2SO2 + O2 ?? 2SO3
开始时 ? 0.050 mol? 0.030 mol? 0
反应了 ? 2x
本题难度:困难
3、选择题 下列实验用来证明SO2的存在,其中正确的是
①能使品红溶液褪色②能使湿润的蓝色石蕊试纸变红③能使澄清的石灰水变浑浊④通入足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸⑤通入溴水能使溴水褪色,再滴入Ba(NO3)2溶液,有白色沉淀生成
A.都能证明
B.都不能证明
C.①⑤能证明
D.只有⑤能证明
参考答案:D
本题解析:①错,能使品红溶液褪色的气体有二氧化硫或氯气等气体;②错,能使湿润的蓝色石蕊试纸变红的气体除二氧化硫外还可以是HCL气体等;③错,能使澄清的石灰水变浑浊的气体可以是二氧化硫或二氧化碳气体;④通入足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸的气体可以是二氧化硫或二氧化碳气体;⑤正确;
本题难度:一般
4、填空题 直接排放含SO2,的烟气会形成胶雨,危害环境。利用钠碱循环法可脱除烟气中的SO2
(1)在钠碱循环法中,Na2 SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,
该反应的离子方程式是????????????????????????
(2)吸收液吸收SO2的过程中,pH随n(SO3?-):n(HSO3﹣变化关系如下表:
n(SO3?--):n(HSO3﹣)
| 91:9
| 1:1
| 9:91
| PH
| 8.2
| 7.2
| 6.2
①上表判断NaHSO3溶液显 性,原因: ???????????
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a、C(Na+)==2C(SO32-)+C(HSO3-)
b、C(Na+)> C(HSO3-)> C(SO32-)>C(H+)==C(OH-)
c、C(Na+)+ C(H+)="=" C(SO32-)+ C(HSO3-)+ C(OH-)
参考答案:2OH-+SO2=H2O+SO32-
①酸???? H
本题解析:(1)SO2是酸性氧化物,和氢氧化钠反应的方程式为2OH-+SO2=H2O+SO32-。
(2)①根据表中数据可知,当溶液中亚硫酸钠和亚硫酸氢钠的物质的量是1︰1时,溶液显酸性。这是由于 HSO3-存在电离平衡HSO3- ?H++SO32-和水解平衡HSO3-+H2O ?H++SO32-和水解平衡HSO3-+H2O  本题难度:一般 本题难度:一般
5、选择题 下列制取硫酸铜的实验设计中,能体现“经济、高效、环保”精神的最佳方案是( )。
A.铜与浓硫酸共热
B.用铜片为阳极,石墨为阴极,电解稀硫酸
C.先灼烧废铜屑生成氧化铜,然后再用浓硫酸溶解
D.适当温度下,使铜片在持续通入空气的稀硫酸中溶解
参考答案:D
本题解析:A项有SO2生成;B项耗能较多;C项也耗能过多。
本题难度:一般
|
|