微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快是[???? ]
A.v(H2)=0.1 mol/(L·min)
B.v(N2)=0.1mol/(L·min)
C.v(NH3)=0.15mol/(L·min)
D.v(N2)=0.02mol/(L·s)
参考答案:D
本题解析:
本题难度:简单
2、选择题 在一定条件下,将2 mol X和3 mol Y充入一密闭容器中,发生如下可逆反应:nX(g)+3Y(g)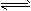 2Z(g)达到平衡时,X的转化率为a%,Y的转化率为b%,若a<b,则n的值为 [???? ]
2Z(g)达到平衡时,X的转化率为a%,Y的转化率为b%,若a<b,则n的值为 [???? ]
A.1
B.2
C.3
D.4
参考答案:A
本题解析:
本题难度:一般
3、填空题 已知CO2(g)+H2(g)  CO(g)+H2O(g)的平衡常数随温度变化如下表:
CO(g)+H2O(g)的平衡常数随温度变化如下表:
t/℃
| 700
| 800
| 850
| 1 000
| 1 200
|
K
| 2.6
| 1.7
| 1.0
| 0.9
| 0.6
?
请回答下列问题:
(1)上述正向反应是________反应(选填“放热”或“吸热”)。
(2)能判断该反应达到化学平衡状态的依据是________。(填编号)
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
E.混合气体的密度不变
(3)在850 ℃发生上述反应,以表中的物质的量投入恒容反应器中,其中向正反应方向进行的有________(选填A、B、C、D、E)。
?
| A
| B
| C
| D
| E
| n(CO2)
| 3
| 1
| 0
| 1
| 1
| n(H2)
| 2
| 1
| 0
| 1
| 2
| n(CO)
| 1
| 2
| 3
| 0.5
| 3
| n(H2O)
| 5
| 2
| 3
| 2
| 1
?
(4)在850 ℃时,可逆反应:CO2(g)+H2(g)??CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
时间
/min
| CO2
(mol·L-1)
| H2
(mol·L-1)
| CO
(mol·L-1)
| H2O
(mol·L-1)
| 0
| 0.200
| 0.300
| 0
| 0
| 2
| 0.138
| 0.238
| 0.062
| 0.062
| 3
| c1
| c2
| c3
| c3
| 4
| c1
| c2
| c3
| c3
?
则3 min~4 min平衡后c3=________mol·L-1,CO2的转化率为________。
参考答案:(1)放热 (2)C (3)A (4)0.12 60%
本题解析:(1)由表可知温度升高,K减小,说明温度升高,平衡逆向进行,正反应为放热反应。(2)因为该反应为反应前后气体分子数不变的反应,所以压强不变,平均相对分子质量不变,均不能说明达到平衡状态,A、D错;选项B中CO2和CO的浓度相等,不能说明其浓度不再变化,故B错;生成CO2代表逆反应,消耗H2代表正反应,且比值等于反应方程式中的对应化学计量数之比,选项C正确;气体的质量不变且为恒容容器,所以气体密度不变不能说明达到平衡状态。(3)计算各组的浓度商:QA= <1 QB= <1 QB= >1 QD= >1 QD=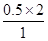 =1 QE= =1 QE=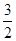 >1 >1
由浓度商QC<K,反应正向进行推断,A项向正反应方向进行。
(4)850 ℃,K=1,设CO2的转化量为x由
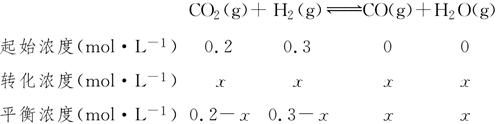
则平衡常数K=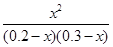 =1 =1
所以x=0.12,故c3=0.12,
α(CO2)= ×100%=60%。 ×100%=60%。
本题难度:一般
4、填空题 在一体积为1L的容器中,通入一定量的N2O4,在100℃时发生如下反应,N2O4 2NO2–Q(Q>0),其N2O4和NO2浓度变化如图如示。 2NO2–Q(Q>0),其N2O4和NO2浓度变化如图如示。

(1)上述反应的平衡常数表达式为______________,升高温度K值_______(填“增大”、“减小”或“不变”)
(2)在0-60s这段时间内,四氧化二氮的平均反应速率为________mol/L.s
(3)120℃时,在相同的容器中发生上述反应,容器内各物质的物质的量变化如图:
| 时间(s)
| N2O4 (mol)
| NO2 (mol)
| 0
| 0.100
| 0.000
| 20
| 0.060
| 0.080
| 40
| C1
| C2
| 60
| C1
| C2
| 80
| 0.070
| 0.160
?
?
??
①该温度时,反应处于平衡状态的时间是____________,C1的数值_____0.04(填“大于”、“小于”或“等于”。
②反应在60-8 0s间平衡向逆反应方向移动,可能的原因是(??????) 0s间平衡向逆反应方向移动,可能的原因是(??????)
(A)使用催化剂???(B)减少N2O4的浓度??
(C)减小体系压强??(D)增加NO2的浓度
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
5、选择题 相同温度下,体积均为0.?25?L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) 2XY3(g)????△H=-92.6?kJ·mol-1 实验测得反应在起始、达到平衡时的有关数据如下表所示 2XY3(g)????△H=-92.6?kJ·mol-1 实验测得反应在起始、达到平衡时的有关数据如下表所示
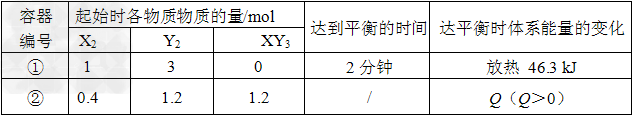
下列叙述不正确的是 [???? ]
A.容器①中反应从开始到刚达平衡时用XY3表示的反应速率为v(XY3)=1/30?mol·L-1·s-1
B.达平衡时,两个容器中XY3的物质的量浓度相等
C.容器②中反应达到平衡时吸收的热量为Q
D.若容器①体积为0.3?L,则达平衡时放出的热量大于46.3kJ
参考答案:D
本题解析:
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|
|
|