微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上用MnO2和KOH为原料制取KMnO4,主要生产过程分两步进行:第一步,将MnO2、KOH粉碎混合均匀,在空气中加热熔化并不断搅拌,制取K2MnO4;第二步,将K2MnO4的浓溶液进行电解,制取KMnO4。
(1)制取K2MnO4的化学方程式是_______________________ 。
(2)电解K2MnO4溶液时,两极发生的电极反应分别是:阳极___________,阴极____________,电解的总方程式_____________________________。
参考答案:(1)2MnO2+4KOH+O2=2K2MnO4+2H2O<
本题解析:
本题难度:一般
2、选择题 用石墨做电极电解CuSO4溶液.通电一段时间后,欲使用电解液恢复到起始状态,应向溶液中加入适量的( )
A.CuSO4
B.H2O
C.CuO
D.CuSO4?5H2O
参考答案:CuSO4溶液存在的阴离子为:SO42-、OH-,OH-离子
本题解析:
本题难度:简单
3、填空题 (15分)认真观察下列装置,回答下列问题:
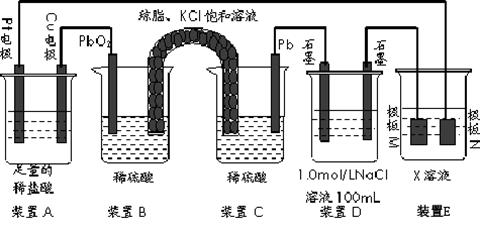
(1)装置B中PbO2上发生的电极反应方程式为 。
(2)装置A中总反应的离子方程式为 。
(3)若装置E中的目的是在Cu材料上镀银,则极板N的材料为 。
若装置E的目的是验证金属的电化学防腐,则极板N的材料为__________________ 。
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为 L(标准状况下)。
参考答案:19.(1)PbO2+4H++SO42-+2e-=PbSO4
本题解析:
试题分析:(1)根据装置图可知,BC是原电池,二氧化铅是正极,得到电子,电极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O
(2)A中铜电极和正极相连,是阳极,铜失去电子。阴极是Pt,溶液中的氢离子得到电子,所以总的反应式为Cu+2H+ Cu2++H2↑
Cu2++H2↑
(3)电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,所以X是硝酸银溶液,N是阳极,则N是银。由于N是阳极,所以若装置E的目的是验证金属的电化学防腐,则极板N的材料应为惰性电极。
(4)当装置A中Cu电极质量改变6 .4g时,转移电子是6.4g÷64g/mol×2=0.2mol。装置D中氯化钠是0.1mol,阴极是氢离子放电,氢气是0.1mol。阳极是氯离子放电,生成氯气,物质的量是0.05mol,所以阴极还生成氧气,物质的量是0.1mol÷4=0.025mol,所以标准状况下的体积共计是(0.1mol+0.05mol+0.025mol)×22.4L/mol=3.92L.。
考点:考查铅蓄电池,电解。
本题难度:一般
4、简答题 Ⅰ.工业上用电解熔融氧化铝的方法来制取金属铝.纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在1000℃左右就可以得到熔融体.
图1是电解槽的示意图.
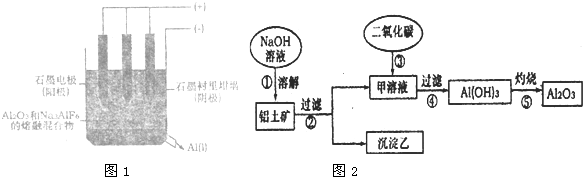
(1)写出电解时阴扳的电极反应式______.
(2)电解过程中生成的氧气全部与石墨电极反应生成C0和C02气体.因此,需要不断补充石墨电极.工业生产中,每生产9t铝阳极损失5.4t石墨.生成的二氧化碳的物质的量为______
Ⅱ.工业上用铝土矿(主要成分是Al2O3,还含有Fe203、Si02)提取氧化铝做冶炼铝的原料.其中一种提取的搡作过程如(图2):
请回答下列问题:
(1)请写出甲溶液中通入足量二氧化碳生成氢氧化铝的离子方程式______.
(2)沉淀乙是Fe203和Si02的混合物,向其中加入足置盐酸,写出反应的离子方程式______,充分反应后过滤,将滤液加热蒸干灼烧,最后可得到红褐色固体,用简要的文字和化学方程式说明这一变化过程______.
(3)上述提取氧化铝的方法叫碱溶法.工业生产中还有一种酸溶法.
第一步:向铝土矿中加盐酸,然后过滤;第二步:处理得到的滤液.请你思考第二步操作中使用的化学试剂是______.
参考答案:Ⅰ.(1)由电解装置可知,阴极上铝离子得到电子,电极反应为A
本题解析:
本题难度:一般
5、填空题 以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如下装置进行电化学浸出实验
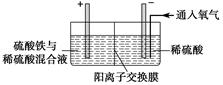
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)  R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是____________。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是______________________。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式____________________。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是__________;加入有机萃取剂的目的是__________。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是____________。
(5)步骤Ⅳ,若电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是__________。
参考答案:(1)①吸收硫化氢气体,防止环境污染
②Fe2+-e-
本题解析:(1)根据2Fe3++H2S=2Fe2++S↓+2H+,可判断Fe2(SO4)3的主要作用是氧化H2S气体,防止H2S对环境的污染,当Fe3+被H2S还原为Fe2+后,在阳极上Fe2+-e-=Fe3+,使Fe3+的浓度基本保持不变。
(2)在阴极上,2H++2e-=H2↑,然后Cu2++2e-=Cu,接着在酸性条件下,Cu被O2氧化成CuO,CuO和H2SO4反应生成CuSO4。
(3)有机相和水相不混溶,所以应用分液漏斗分离,由于Cu2+在有机相中,所以加入有机萃取剂可富集Cu2+。
本题难度:一般