微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于钠和钠的化合物的性质或用途相关叙述不正确的是
A.用钠作还原剂可以从锆的氯化物中制备锆
B.钠和钾的合金常温下为液体,用于快中子反应堆作热交换剂
C.苏打固体的pH强于小苏打固体的pH
D.热的碳酸钠溶液有去油污的作用
2、实验题 在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式:????????????????????????????????????????????????。
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是???????????。
 ?
?
A????????????????? B???????????????? C???????????????????? D
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入????????????
???????????????????????????振荡,观察?????????????????
| 现象:溶液中产生大量白色沉淀;
结论:????????????????????????????。
|
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入???????????????????????,
振荡,观察
| ?
现象:???????????????????????????;
结论:样品中含有NaHCO3。
|
步骤三:将步骤二的浊液过滤,取滤液于试管C中,?????????????????????????????
??????????????????????????振荡,观察
| ?
现象:???????????????????????????;
结论:????????????????????????????。
?
(4)用碘量法测量自来水中残留的Cl2的浓度:
① 在大锥形瓶中放置过量的KI,加一定量的冰醋酸,准确取水样200mL加入瓶中,迅速塞上瓶塞摇动,水样呈淡黄色,发生反应:Cl2+2I-=2Cl-+ I2。
②加少许淀粉溶液,用cmol/L Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当????????????????????????????????????????????????????????????,达到滴定终点。
③重复操作3次,平均读数为V mL,则该样品中残留Cl2的浓度:?????????mg/L(Cl的相对原子质量:35.5)
3、填空题 有A、B、C、D四种钠的化合物,根据下列反应式判断A、B、C、D的化学式。
A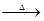 B+CO2+H2O ;D+CO2 B+CO2+H2O ;D+CO2 B+O2 ;D+H2O B+O2 ;D+H2O C+O2↑; C+O2↑;
B+Ca(OH)2 C+CaCO3↓。 C+CaCO3↓。
(1)写出A、B、C、D的化学式:A__________,B_________,C__________,D__________。
(2)1mol D 与足量CO2反应生成标准状况下的O2 的体积为_____。
4、选择题 下面对有关实验事实的叙述正确的是? (?? )
①向2mLl0%NaOH溶液中滴入2%CuSO4溶液的4—6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,则有红色沉淀出现。
②钠在氯气中能剧烈地燃烧并产生大量的白烟
③将等质量的Na2CO3与NaHCO3分别投入到盛有等体积等物质的量浓度的两支试管中,后者反应较前者剧烈。
④向盛有2mL苯酚溶液的试管中加入几滴溴水会立即产生白色沉淀。
⑤向盛有FeSO4的溶液中直接滴加NaOH溶液,可以看到试管底部有大量的白色沉淀出现。
A.①②③④⑤
B.①②③
C.②③④
D.①③④
5、填空题 (10分)钠和铝是两种重要的金属。请回答:
(1)钠元素的金属性比铝的?????????(填“强”或“弱”);常温下,可用?????????(填“钠”或“铝”)制成的容器盛装浓硫酸或浓硝酸。
(2)将一小块金属钠投入水中,发生反应的化学方程式为????????????????????????;可观察到的实验现象是?????????(填序号)。
a.钠沉到水底??? b.钠熔成小球??? c.小球四处游动
(3)铝与氢氧化钠溶液反应的离子方程式为?????????????????????????。
|