微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于钠和钠的化合物的性质或用途相关叙述不正确的是
A.用钠作还原剂可以从锆的氯化物中制备锆
B.钠和钾的合金常温下为液体,用于快中子反应堆作热交换剂
C.苏打固体的pH强于小苏打固体的pH
D.热的碳酸钠溶液有去油污的作用
参考答案:C
本题解析:略
本题难度:一般
2、实验题 在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式:????????????????????????????????????????????????。
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是???????????。
 ?
?
A????????????????? B???????????????? C???????????????????? D
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入????????????
???????????????????????????振荡,观察?????????????????
| 现象:溶液中产生大量白色沉淀;
结论:????????????????????????????。
|
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入???????????????????????,
振荡,观察
| ?
现象:???????????????????????????;
结论:样品中含有NaHCO3。
|
步骤三:将步骤二的浊液过滤,取滤液于试管C中,?????????????????????????????
??????????????????????????振荡,观察
| ?
现象:???????????????????????????;
结论:????????????????????????????。
?
(4)用碘量法测量自来水中残留的Cl2的浓度:
① 在大锥形瓶中放置过量的KI,加一定量的冰醋酸,准确取水样200mL加入瓶中,迅速塞上瓶塞摇动,水样呈淡黄色,发生反应:Cl2+2I-=2Cl-+ I2。
②加少许淀粉溶液,用cmol/L Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当????????????????????????????????????????????????????????????,达到滴定终点。
③重复操作3次,平均读数为V mL,则该样品中残留Cl2的浓度:?????????mg/L(Cl的相对原子质量:35.5)
参考答案:(16分)
(1) NaCl + NH3 + CO2
本题解析:
试题分析:(1)氨气易溶于饱和食盐水,且NH3+H2O=NH3?H2O,得到氯化钠、氨水溶液;一水合氨是弱碱,二氧化碳是酸性氧化物,不断通入二氧化碳气体时,NH3?H2O+CO2=NH4HCO3;由于碳酸氢钠的溶解度比氯化钠、碳酸氢铵都小,碳酸氢钠最先达到饱和,则碳酸氢铵与氯化钠容易反应,生成碳酸氢钠晶体和氯化铵溶液,即NH4HCO3+NaCl=NaHCO3↓+NH4Cl;上述几步反应加起来可得:NaCl + NH3 + CO2 91exam .org+ H2O = NaHCO3 ↓+ NH4Cl;(2)碳酸氢钠是固体
本题难度:困难
3、填空题 有A、B、C、D四种钠的化合物,根据下列反应式判断A、B、C、D的化学式。
A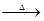 B+CO2+H2O ;D+CO2 B+CO2+H2O ;D+CO2 B+O2 ;D+H2O B+O2 ;D+H2O C+O2↑; C+O2↑;
B+Ca(OH)2 C+CaCO3↓。 C+CaCO3↓。
(1)写出A、B、C、D的化学式:A__________,B_________,C__________,D__________。
(2)1mol D 与足量CO2反应生成标准状况下的O2 的体积为_____。
参考答案:(1)NaHCO3 、Na2CO3、NaOH、Na2O2??
本题解析:由于四种物质都含有钠元素,所以根据转化关系可知,A是碳酸氢钠,B是碳酸钠,C是氢氧化钠,D是过氧化钠。过氧化钠和CO2反应的方程式为2Na2O2+2CO2=2Na2CO3+O2,所以1mol过氧化钠生成0.5mol氧气,在标准状况下的体积是0.5mol×22.4L/mol=11.2L。
本题难度:一般
4、选择题 下面对有关实验事实的叙述正确的是? (?? )
①向2mLl0%NaOH溶液中滴入2%CuSO4溶液的4—6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,则有红色沉淀出现。
②钠在氯气中能剧烈地燃烧并产生大量的白烟
③将等质量的Na2CO3与NaHCO3分别投入到盛有等体积等物质的量浓度的两支试管中,后者反应较前者剧烈。
④向盛有2mL苯酚溶液的试管中加入几滴溴水会立即产生白色沉淀。
⑤向盛有FeSO4的溶液中直接滴加NaOH溶液,可以看到试管底部有大量的白色沉淀出现。
A.①②③④⑤
B.①②③
C.②③④
D.①③④
参考答案:B
本题解析:④中苯酚只有与过量浓溴水作用时才能产生白色沉淀;②钠在氯气燃烧可生成NaCl固体小微粒而形成白烟;⑤中操作因空气中氧气的介于,生成的Fe(OH)2迅速被氧化成Fe(OH)3而无法在试管底部出现大量白色沉淀;
本题难度:简单
5、填空题 (10分)钠和铝是两种重要的金属。请回答:
(1)钠元素的金属性比铝的?????????(填“强”或“弱”);常温下,可用?????????(填“钠”或“铝”)制成的容器盛装浓硫酸或浓硝酸。
(2)将一小块金属钠投入水中,发生反应的化学方程式为????????????????????????;可观察到的实验现象是?????????(填序号)。
a.钠沉到水底??? b.钠熔成小球??? c.小球四处游动
(3)铝与氢氧化钠溶液反应的离子方程式为?????????????????????????。
参考答案:(1)强??铝??(2)2Na? +? 2H2O? ="?"
本题解析:略
本题难度:一般
|