微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+溶度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是
A.2 :3
B.3 :2
C.1 :2
D.1 :1
参考答案:A
本题解析:
试题分析:已反应的Fe3+和未反应的Fe3+的物质的量分别是x和y,则根据方程式可知
2Fe3++Fe=3Fe2+
2mol? 1mol 3mol
x????????? 1.5x
所以y=1.5x
解得x︰y=2 :3
答案选A
点评:该题是基础性试题的考查,难度不大,主要是考查学生灵活运用基础知识解决问题的能力。该题是常规性计算题的考查,直接根据方程式列式计算即可。
本题难度:一般
2、选择题 下列化合物不是黑色的是
A.FeO
B.FeS
C.Fe3O4
D.Fe2O3
参考答案:D
本题解析:
试题分析:氧化铁是红色的,其他都是黑色的,所以选D。
本题难度:简单
3、选择题 向含有FeCl3和BaCl2的酸性溶液中通入足量的SO2,有白色沉淀生成,过滤后向滤液中滴入KSCN溶液时,无明显现象,由此得出的正确结论是(???)
A.白色沉淀是BaSO3
B.白色沉淀是BaSO4
C.白色沉淀是BaSO3和BaSO4的混合物
D.FeCl3已全部被SO2还原成FeCl2
参考答案:BD
本题解析:滤液中滴入KSCN溶液,无明显现象,说明Fe3+与通入的SO2发生了氧化还原反应:2Fe3++SO2+2H2O====2Fe2++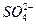 +4H+,此反应中Fe3+被还原为Fe2+。通入SO2后生成白色沉淀,说明上述反应生成的
+4H+,此反应中Fe3+被还原为Fe2+。通入SO2后生成白色沉淀,说明上述反应生成的 本题难度:简单
本题难度:简单
4、简答题 (15 分)废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
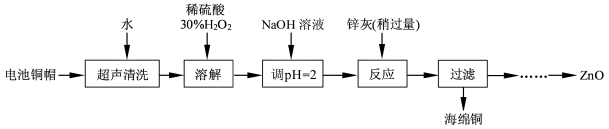
(1)①铜帽溶解时加入H2O2的目的是???????????????????????????????????(用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的H2O2除去。除去H2O2的简便方法是????????????????。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2???? 2S2O32- +I2=2I-+S4O62-
①滴定选用的指示剂为???????????????,滴定终点观察到的现象为??????????????????????。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会???(填“偏高”、“偏低”或“不变”)。
(3)已知pH>11 时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 mol·L-1计算)。
?
| 开始沉淀的pH
| 沉淀完全的pH
|
Fe3+
| 1. 1
| 3. 2
|
Fe2+
| 5. 8
| 8. 8
|
Zn2+
| 5. 9
| 8. 9
实验中可选用的试剂:30%H2O2、1. 0 mol·L-1HNO3、1. 0 mol·L-1NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:①??????;②???????;③过滤;④??????????;⑤过滤、洗涤、干燥;⑥900℃煅烧。
参考答案:(1)①Cu+H2O2+H2SO4=CuSO4+2H2O??
本题解析:(1)目标反应可由已知的两个反应相加得到,反应热也有对应法则求得;该反应类似于复分解或盐的水解,但生成的气体是甲烷;
(2)稀有气体如果不是反应物,一般作保护区,防止金属被氧化;氢气的计算可理解为原储氢材料中存储的氢全部放出,另外金属材料再与酸反应也生成氢气,则可计算出生成52molH2。由于Al的衍射强度较低,即铝参与了反应,所以铝是主要产生氢气的物质。
(3)铝是负极是材料,参与负极反应,铝失去电子并与介质中氢氧根离子反应生成偏铝酸根离子,正极氧化银得到电子生成银。
【考点定位】废电
本题难度:一般
5、简答题 利用染化厂的废料铁泥(主要成分是Fe2O2、FeO和铁)制备可用于隐形飞机涂层的纳米四氧化三铁的生产流程为:
请回答:
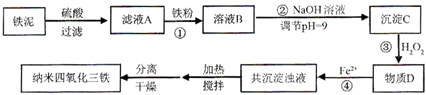
(1)在物质分类中,纳米四氧化三铁的主要成分属于______;
(2)过程①主要反应的离子方程式为______;
(3)已知氢氧化亚铁的Ksp=1×10-13,氢氧化铁的Ksp=1×10-26,通过计算所得数据说明过程②调节pH=9的原因是______;
(4)物质D的主要产物中铁、氢、氧三种元素的质量比为56:1:32,则过程③主要反应的化学方程式为______;
(5)已知Fe3+在弱碱性溶液中还原性较强,图是研究过程④的实验所得,该实验的结论是______;
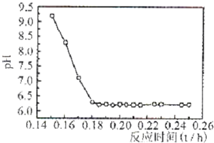
(6)为研究本流程中双氧水的用量,调节的pH、反应时间三个关键生产条件,需要进行七组实验.
①每组实验需要测定并计算得出的数据是______;
②若实验序号1是该流程的理论最佳生产条件,请在表中填入实验序号为5、6、7的三组实验条件.??????
| 实验序号 | 双氧水(mL) | pH | 反应时间
1
0.5
11
3
2
0.4
11
3
3
0.6
11
3
4
0.5
10
3
5
6
7
参考答案:(1)四氧化三铁属于氧化物;故答案为:氧化物;
(2)
本题解析:
本题难度:一般
|
|