微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g) CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是
CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是
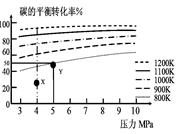
A.上述正反应为吸热反应
B.在4MPa、1200K时,图中X点υ(H2)正 >υ(H2)逆
C.在5MPa、800K时,该反应的平衡常数为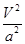 L2·mol-2
L2·mol-2
D.工业上维持6MPa 1000K而不采用10MPa1000K,主要是因
为前者碳的转化率高
参考答案:AB
本题解析:
试题分析:A、由图观察,温度越高碳的平衡转化率越大,平衡正向移动,正反应为吸热反应,正确;B、X点是未平衡时,反应正向进行,正反应速率大于逆反应速率,正确;
C、此时碳转化率为50%
C(s)+2H2(g) CH4(g)
CH4(g)
始量?? a???? 2a
转化量0.5a?? a?????? 0.5a
平衡量0.5a?? a?????? 0.5a
k="(0.5a/V)/" ( a/V)2=0.5V/a,错误;
D、该选择的原因是两者转化率相差不大,但压强增大对设备要求高,能量需求大,错误。
本题难度:一般
2、选择题 已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。
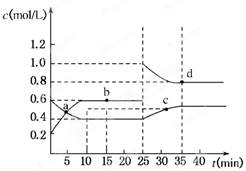
下列推理分析合理的是
A.前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min)
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.a、b、c、d四点中v正与v逆均相等
D.25 min时,导致平衡移动的原因是升温
参考答案:B
本题解析:略
本题难度:一般
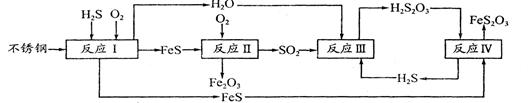
3、填空题 中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究 院对四川泸天化尿塔腐蚀过程进行研究,得出下列腐蚀机理:
(1)H2S来自合成尿素的天然气。在380 K、体积为2 L的密闭容器中,存在如下反应:H2(g)+S(s) H2S(g)??△H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
H2S(g)??△H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
(2)在反应I中发生的化学反应为______。
(3)研究发现反应II是分别以Fe、FeS为电极,以水膜为电解质溶液的电化学腐蚀,其 负
极为______;
已知:Fe(s)+S(s)=FeS(s)?△H1=-2.5akJ·mol-1?
S(s)+O2(g)=SO2(g)??△H2=-5akJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s)?△H3=-6akJ·mol-1
则反应II的热化学方程式为_____?????????????????????????????????????????
(4)已知H2S2O3的K1=2.2×10-1、K2=2.8×10-2。Na2S2O3水溶液呈______性,该溶液中电荷守恒式为_____???????????????????????????????????????????????????????;反应IY的反应类型为______?????????;该反应______(填“能”或“不能”) 说明FeS溶解性强于FeS2O3
(5)泸天化尿塔的最终腐蚀产物为______;为了有效防腐,北钢建议泸天化在生产中用 CuSO4溶液“脱硫(H2S)”,其中涉及的离子方程式为
__________________???????????????????????????????????????????????????
参考答案:(1)除去铁钉表面的铁锈;(2)⑤①④②③(3)4Fe+3O
本题解析:
试题分析:(1)反应前后气体的体积不变,用平衡时H2、H2S的物质的量代替浓度计算,故该反应的平衡常数k=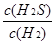 =
=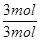 =1;A.该反应正反应是吸热反应,温度升高平衡向正反应移动,平衡常数增大,图象与实际相符合,正确;B.增大压强平衡不移动,但容器体积减小,硫化氢的浓度增大,正确;C.升高温度反应速率加快,图象中正反应速率不变,错误;D.增大硫化氢的浓度,等效为增大压强,平衡不移动,各组分的含量不变,图象与实际不相符,错误;(2)由流程图可知,反应I中铁与硫化氢、氧气反应生成FeS与水,反应方程式为:2Fe+2H2S+O2=2FeS+2H2O;(3)由流程图可知,反应II中FeS与氧气反应生成氧化铁与二氧化硫,FeS发生氧化反应,为负极;已知:①Fe(s)+S(s)═FeS(s)△H1═-2.5akJ/mol;
=1;A.该反应正反应是吸热反应,温度升高平衡向正反应移动,平衡常数增大,图象与实际相符合,正确;B.增大压强平衡不移动,但容器体积减小,硫化氢的浓度增大,正确;C.升高温度反应速率加快,图象中正反应速率不变,错误;D.增大硫化氢的浓度,等效为增大压强,平衡不移动,各组分的含量不变,图象与实际不相符,错误;(2)由流程图可知,反应I中铁与硫化氢、氧气反应生成FeS与水,反应方程式为:2Fe+2H2S+O2=2FeS+2H2O;(3)由流程图可知,反应II中FeS与氧气反应生成氧化铁与二氧化硫,FeS发生氧化反应,为负极;已知:①Fe(s)+S(s)═FeS(s)△H1═-2.5akJ/mol;
②S(s)+O2(g)═SO2(g)△H2═-5akJ/mol9;
③4Fe(s)+3O2(g)═2Fe2O3(s)△H3═-6akJ/mol
根据盖斯定律,③-①×4+②×4得:4FeS(s)+7O2(g)═2Fe2O3(s)+4SO2(g)△H=-16akJ/mol
(4)由电离平衡常数可知,H2S2O3属于弱酸,Na2S2O3为强碱弱酸盐,溶液呈碱性;
阳离子带的电离等于阴离子带的电离,故c(Na+)+c(H+)=2c(S2O32-)+c(HS2O3-)+c(OH-);
反应Ⅳ是H2S2O3与FeS反应生成FeS2O3与H2S,方程式为:H2S2O3+FeS=FeS2O3+H2S↑,符合复分解反应,反应能进行由于生成硫化氢气体,不能说明FeS溶解性更强,(5)由流程图可知,最终腐蚀产物为Fe2O3、FeS2O3;硫化氢与硫酸铜反应生成硫化铜沉淀与硫酸,反应离子方程式为:Cu2++H2S=CuS↓+2H+。
本题难度:困难
4、选择题 有A、B两个起始容积相等的恒温密闭容器,A保持恒压,B保持恒容.起始时向A、B中均通入2molSO2和1molO2后,在一定条件下反应达到平衡.则下列说法中不正确的是
A.达到平衡时,SO2的转化率:A<B
B.起始时的反应速率:A=B,反应完成时的平均速率:A<B
C.达到平衡后再充入等量氦气,A、B中平衡均不发生移动
D.若再向A中充入2molSO3,平衡时SO2的质量分数不变
参考答案:BCD
本题解析:2SO2+O2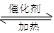 2SO3属于正反应气体系数减小的可逆反应,反应进行时气体的总物质的量减小,A容器恒压,容器内气体的压强不变,而B容器恒容,容器内气体的压强减小,故A相对于B来说,相当于加压
2SO3属于正反应气体系数减小的可逆反应,反应进行时气体的总物质的量减小,A容器恒压,容器内气体的压强不变,而B容器恒容,容器内气体的压强减小,故A相对于B来说,相当于加压
A:加压,平衡正向移动,SO2的转化率增大,故A>B,不正确
B:起始时两容器反应状态完全相同,反应速率相等,反应完成时,A容器内压强大,反应速率快,即A>B,不正确
C:达到平衡后再充入等量氦气,A容器相当于减压,平衡左移,而B容器内各物质的浓度不变,正逆反应速率仍旧相等,平衡不移动,不正确
D:在恒压情况下,若再向A中充入2molSO3,与原平衡等效,平衡时SO2的质量分数不变,正确
故答案为BCD
本题难度:一般
5、选择题 在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡.其初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z
初始浓度/mol?L-1
0.1
0.2
0
平衡浓度/mol?L-1
0.05
0.05
0.1
下列说法错误的是( )
A.该反应可表示为X+3Y?2Z
B.反应达到平衡时,X的转化率为50%
C.前5min?以Y表示的平均反应速率为υ(Y)=0.01?mol?L-1?min-1
D.增大压强使平衡向生成Z的方向移动
参考答案:A、5min后达到平衡,X的消耗浓度为0.05mol/L;Y
本题解析:
本题难度:一般
|