微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实不能用勒夏特列原理解释的是(??)
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③实验室可用排饱和食盐水的方法收集氯气
④常温下,将1 mL pH=3的醋酸加水稀释至100 mL,测得其pH<5
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)  K(g)+NaCl(l)
K(g)+NaCl(l)
⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深
A.①②③
B.②⑥
C.①③④⑤
D.②⑤⑥
参考答案:B
本题解析:②不是化学平衡;⑥平衡的移动应使颜色变浅,颜色变深是体积缩小、浓度变大造成的。
本题难度:一般
2、选择题 已知2SO2+O2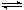 2SO3;△H=-92.6 kJ·mol-1,当反应达到平衡时,下列措施:①降低温度;②减小压强;③用V2O5作催化剂;④增大O2的浓度;⑤增大SO2的浓度;⑥恒压通入He气,能提高SO2转化率的是
2SO3;△H=-92.6 kJ·mol-1,当反应达到平衡时,下列措施:①降低温度;②减小压强;③用V2O5作催化剂;④增大O2的浓度;⑤增大SO2的浓度;⑥恒压通入He气,能提高SO2转化率的是
A.①②⑥
B.①④⑤
C.④⑤⑥
D.①④
参考答案:D
本题解析:略
本题难度:一般
3、填空题 化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) ΔH>0(I)
TaI4(g)+S2(g) ΔH>0(I)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
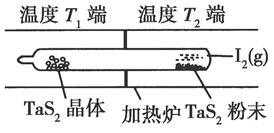
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为______________________。
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中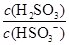 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。
参考答案:(1)[c(TaI4)·c(S2)]/c2(I2) 66.7
本题解析:结合题给可逆反应的特点,应用化学平衡移动原理,分析化学平衡、电离平衡和水解平衡问题。
(1)反应(Ⅰ)中,TaS2为固体,则平衡常数表达式K=[c(TaI4)·c(S2)/c2(I2)]。设平衡时,I2转化的物质的量为x,则有
TaS2(s)+2I2(g) TaI4(g)+S2(g)
TaI4(g)+S2(g)
起始/mol???????????1???????0?????0
转化/mol ???????????x??????0.5x???0.5x
平衡/mol?????????1-x ?????0.5x ???0.5x
此时平衡常数K为1,则有[(0.5x)·(0.5x)]/(1-x)2=1,从而可得x=2/3 mol,I2(g)的转化率为(2/3 mol)/1 mol×100%≈66.7%。
(2)由题意可知,未提纯的TaS2粉末变成纯净TaS2晶体,要经过两步转化:①TaS2+2I2=TaI4+S2,②TaI4+S2=TaS2+2I2,即反应(Ⅰ)先在温度T2端正向进行,后在温度T1端逆向进行,反应(Ⅰ)的ΔH大于0,因此温度T1小于T2,该过程中循环使用的是I2。
(3)淀粉遇单质I2显蓝色,利用I2溶液滴定H2SO3时,常用淀粉作指示剂,达到终点时,溶液由无色变成蓝色,滴定反应的离子方程式为I2+H2SO3+H2O=4H++2I-+SO42-。
(4)H2SO3的电离常数Ka=[c(HSO3-)·c(H+)]/c(H2SO3)=1×10-2 mol·L-1,水的离子积常数KW=c(H+)·c(OH-)=1×10-14mol2·L-2,综上可得Ka=[c(HSO3-)·KW]/[c(H2SO3)·c(OH-)]。NaHSO3溶液中HSO3-的水解反应为HSO3-+H2O H2SO3+OH-,则水解平衡常数Kh=[c(H2SO3)·c(OH-)]/c(HSO3-)=KW/Ka=(1×10-14mol2·L-2)/(1×10-2mol·L-1)=1×10-12mol·L-1。NaHSO3溶液中加入少量I2,二者发生氧化还原反应,溶液中c(HSO3-)减小,HSO3-的水解程度增大,c(H2SO3)/c(HSO3-)将增大。
H2SO3+OH-,则水解平衡常数Kh=[c(H2SO3)·c(OH-)]/c(HSO3-)=KW/Ka=(1×10-14mol2·L-2)/(1×10-2mol·L-1)=1×10-12mol·L-1。NaHSO3溶液中加入少量I2,二者发生氧化还原反应,溶液中c(HSO3-)减小,HSO3-的水解程度增大,c(H2SO3)/c(HSO3-)将增大。
点拨:知识:平衡常数及转化率;平衡移动及影响因素;氧化还原滴定及指示剂的选择;电离平衡常数和水解平衡常数的计算。能力:考查考生的综合应用能力、分析问题和解决问题的能力,以及简单计算的能力。试题难度:较大。
本题难度:一般
4、填空题 (10分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如右图:

(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K=???????????????;反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=???????????????;反应的平衡常数随温度的变化如下表:
温度/℃
| 400
| 500
| 830
| 1000
|
平衡常数K
| 10
| 9
| 1
| ?
从上表可以推断:此反应是???????(填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1mo1,则达到平衡后CO的转化率为????????。
(2)在830℃,以下表的物质的量(单位为mol)投入恒容反应器发生上述第II步反应,其中反应开始时,向正反应方向进行的有????????(填实验编号);
实验编号
| n(CO)
| n(H2O)
| n(H2)
| n(CO2)
| A
| 1
| 5
| 2
| 3
| B
| 2
| 2
| 1
| 1
| C
| 0.5
| 2
| 1
| 1
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是???????????。
①体系的压强不再发生变化?????????????????????????②混合气体的密度不变
③混合气体的平均相对分子质量不变???????????④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化?????????????????????????⑥v(CO2)正=v(H2O)逆
(4)右图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是(写出两种)??????????????????????????。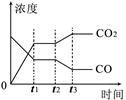
参考答案:(1) 本题解析:(1)分析表格数据,得:升温K值减小,即平衡逆向移动,说明逆向是吸热反应,则正向为放热反应; 本题解析:(1)分析表格数据,得:升温K值减小,即平衡逆向移动,说明逆向是吸热反应,则正向为放热反应;
830℃? CO(g)+H2O(g) H2(g)+CO2(g) H2(g)+CO2(g)
n0???? 1mo1?? 1mo1????? 0????? 0
n?????? x????? x??????? x????? x
n(平衡)1-x??? 1-x?????? x????? x
则K=x2/(1-x)2=1,求解,得:x="0.5" mo1
所以,达到平衡后CO的转化率=x/1mo1=50%;
(2)利用Q与K的关系求解;利用Q=[C(H2)C(CO2)]/[C(CO)C(H2O)],依次求得Q(A)=1.2、Q(B)=0.25、Q(C)=1;要正向进行,则Q<K,故选B;
(3)因反应前后气态物质系数相等,则无论是否达平衡态,压强都不变,故①不是反应达到平衡的标志;②混合气体的密度=m(气体)/V,因为各物质均为气体,由“质量守恒”得:无论是否达平衡态,m(气体)为一定值,“固定容积的容器”则V为一定值,故②不是反应达到平衡的标志;③混合气体的平均相对分子质量= m(气体)/n(气体),因为各物质均为气体,由“质量守恒”得:无论是否达平衡态,m(气体)为一定值,由化学方程式系数得:无论是否达平衡态,n(气体)为一定值,故③不是反应达到平衡的标志;④是;⑤该反应为放热反应,则体系的温度不变,说明达到了平衡态;⑥是;
(4)分析图像可以看出:在t2时刻,因条件的改变使C(CO2)增大、C(CO)减小,说明平衡正向移动;但不能是增大C(CO)使平衡正向移动(因增大C(CO),能使平衡正向移动,C(CO2)增大,但C(CO)也增大)
本题难度:一般
5、选择题 用水稀释0.1mol· L-1的醋酸溶液,下列说法正确的是
A.醋酸的电离程度逐渐增大,溶液的PH值减小
B.Kw逐渐减小
C.水的电离程度增大
D.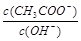 变大 变大
参考答案:C
本题解析:
试题分析:加水稀释醋酸,促进电离,n(H+)增大,c(H+)减小,pH增大,A错误;Kw与温度有关,加水稀释,Kw不变,B错误;加水稀释醋酸,醋酸浓度减小,水的电离程度增大,C正确; ,加水稀释,K(CH3COOH)、Kw不变,c(CH3COOH)减小,所以 ,加水稀释,K(CH3COOH)、Kw不变,c(CH3COOH)减小,所以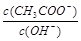 减小,D错误。 减小,D错误。
点评:酸碱抑制水的电离,能水解的盐促进水的电离
本题难度:简单
|
|