微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25 ℃时,水的电离达到平衡:H2O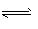 H++OH-;
H++OH-;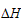 >0,下列叙述正确的是 [???? ]
>0,下列叙述正确的是 [???? ]
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
参考答案:B
本题解析:
本题难度:一般
2、实验题
⑴ 准确称取烧碱样品4.1g,将样品配成250mL的待测液,需要的仪器有托盘天平、小烧杯、量筒、玻璃棒、 、 。(填仪器)
⑵ 用 (“碱式”或“酸式”)滴定管量取10.00mL待测液注入锥形瓶中。
⑶若锥形瓶用蒸馏水洗涤后,水未倒尽,则测得样品中烧碱的质量分数________(填“偏高”、“偏低”或“无影响”)。
⑷若滴定到达终点时,仰视读出滴定管读数;则测得样品中烧碱的质量分数________ (填“偏高”、“偏低”或“无影响”)。
⑸滴定时边滴边摇动锥形瓶,眼睛应观察______。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
⑹滴定达到终点时的现象 。
⑺ 根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
滴定次数
| 待测液体积/mL
| 标准盐酸体积/mL
|
滴定前读数(mL)
| 滴定后读数(mL)
|
第一次
| 10.00
| 0.50
| 20.40
|
第二次
| 10.00
| 4.00
| 24.10
|
第三次
| 10.00
| 5.70
| 25.70
⑻ 已知标准盐酸的浓度为0.2010 mol·L-1,根据上述测定数据,分析得到合理数据,计算烧碱的纯度 。
参考答案:(12分)(6、7、8每空2分,其余1分)
⑴ 250
本题解析:本题考查了中和滴定的基本操作,它也是一个定量实验,一般通过多次测量求平均值的方法进行测定。
(7)三次所耗标准液的体积平均值为:20.00ml,而NaOH溶液为10.00ml,故c(NaOH)=0.4020mol/L,进而求出m(NaOH)="4.020" g,则样品的纯度为: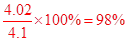
本题难度:困难
3、选择题 对于溶液的酸碱性说法正确的是
A.c(H+)很小的溶液一定呈碱性
B.pH等于7的溶液一定呈中性
C.c(H+)=c(OH-)的溶液一定呈中性
D.不能使酚酞试液变红的溶液一定呈酸性
参考答案:C
本题解析:
试题分析:A.c(H+)很小的溶液不一定呈碱性,只有氢离子浓度小于氢氧根浓度时溶液才能显碱性,A错误;B.pH等于7的溶液不一定呈中性,在100℃时显碱性,B错误;C.c(H+)=c(OH-)的溶液一定呈中性,C正确;D.不能使酚酞试液变红的溶液不一定呈酸性,因为酚酞的变色范围是8.2~10.0,D错误,答案选C。
考点:考查溶液酸碱性判断
本题难度:一般
4、选择题 在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH 溶液,曲线如下图所示,有关粒子浓度关系比较正确的 ( )

A.在A、B间任一点,溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)= c(H+)
C.在C点:c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
参考答案:D
本题解析:
试题分析:若加入醋酸溶液很少,则可能出现c(Na+)> c(OH-)>c(CH3COO-) > c(H+),A错误;当加入12.5mL醋酸时,醋酸与氢氧化钠溶液恰好中和生成醋酸钠溶液,溶液呈碱性,而B点pH=7,说明醋酸过量,a>12.5,溶液中电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),由pH=7得c(Na+)=c(CH3COO-)但不等于c(OH-)= c(H+),B错愕;C点为醋酸和醋酸钠混合溶液,电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)>c(OH-)则c(CH3COO-) > c(Na+),C错误;D点为等物质的量CH3COOH与CH3COONa的混合溶液,由物料守恒得c(CH3COO-)+c(CH3COOH)=2c(Na+),D正确。
考点:考查离子浓度大小比较。
本题难度:一般
5、填空题 (12分)中学化学实验,淡黄色的pH试纸常用于测定溶液的酸碱性。在25 ℃,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在如下平衡H2O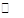 H++OH-ΔH>0。现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母)。 H++OH-ΔH>0。现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母)。
A.向水中加入NaHSO4溶液
B.向水中加入Cu(NO3)2溶液
C.加热水至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.在水中加入(NH4)2SO4溶液
(2)现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,若用pH计测定,则pH 7 (填“>”“<”或“=”),溶液呈 性(填“酸”“碱”或“中”)。
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
| 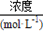
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
参考答案:(1) B、D (2 ) 淡黄 <
本题解析:
试题分析:(1)酸碱抑制水的电离,能水解的盐促进水的电离,欲使水的电离平衡向右移动,且所得溶液呈酸性,需加入水解显酸性的盐,选B、D;
(2)100℃沸水仍然是中性的,pH试纸测定溶液的酸碱性时,中性溶液不变色,所以是淡黄色的,温度升高会促进水的电离,所以水的pH会减小,则若用pH计测定,则PH<7 ;
(3)根据电荷守恒,c(K+)+ c(H+)+ c(Na+)+c(NH4+)= c(OH—)+ 2 c(SO42—)+2 c(NO3—)+ c(Cl—),而c(OH—)·c(H+)=10-14,代入具体数据计算可得:c(OH—)=10-10mol/L,c(H+)=10-4 mol/L,溶液呈酸性,PH=4.
考点:考查水的电离和溶液的酸碱性。
本题难度:困难
|
|