微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电离方程式,书写正确的是( )
A.Ca(OH)2=Ca2++OH-
B.AlCl3=Al3++Cl3-
C.Mg(NO3)2=Mg+2+2NO3-
D.Al2(SO4)3=2Al3++3SO42-
参考答案:D
本题解析:
本题难度:一般
2、选择题 加入水能抑制水的电离的物质是( )
A.碘化钾
B.氯化钠
C.硝酸钠
D.硫酸
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列说法正确的是
A.常温下,在0.1mol/LNaOH溶液和0.1mol/L盐酸中水的离子积相等
B.常温下,在水中加入NaOH,水的电离受到抑制,水的离子积减小
C.HCl溶液中无OH-,NaOH溶液中无H+,NaCl溶液中既无OH-也无H+
D.在水溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
参考答案:A
本题解析:
试题解析:水的离子积常数只受温度的影响,与溶液的酸碱性无关,故A正确;常温下,在水中加入NaOH,水的电离受到抑制,但水的离子积常数不变,故B错误;水是电解质,电离出氢离子和氢氧根,任何水溶液中均存在氢离子和氢氧根,故C错误;溶液的导电能力与离子浓度有关,而与电解质强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,故D错误。
考点:水的电离、水的离子积常数
本题难度:一般
4、填空题 往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图。试回答:
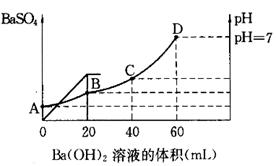
(1)起始时,混酸中H2SO4的物质的量浓度为
(2)起始时,混酸中盐酸的物质的量浓度为
(3)B点时溶液的pH是 。
参考答案:(1)0.05mol/L (2)0.2mol/L&
本题解析:
试题分析:(1)根据图像可知,当加入20ml氢氧化钡时,沉淀达到最大值,所以硫酸的物质的量是0.02L×0.05mol/L=0.001mol,则硫酸的浓度是0.001mol÷0.02L=0.05mol/L。
(2)当Ph=7是,酸碱恰好中和,则盐酸的物质的量是2×0.04L×0.05mol/L=0.004mol,则盐酸的浓度是0.004mol÷0.02L=0.2mol/L。
(3)B点相当于是硫酸被中和,则溶液中氢离子的浓度是 ,所以pH=1。
,所以pH=1。
考点:考查酸碱中和的有关判断以及pH的有关计算
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练。旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确图像的变化趋势特点,然后结合题意灵活运用即可。
本题难度:一般
5、选择题 室温下,在pH=12的某溶液中,分别有甲、乙、丙、丁四位同学计算出由水电离出的c(OH-)的数据分别为:甲:1.0×10-7 mol/L;乙:1.0×10-6 mol/L;丙:1.0×10-2 mol/L;丁:1.0×10-12 mol/L。其中你认为可能正确的数据是[???? ]
A.甲、乙
B.乙、丙
C.丙、丁
D.乙、丁
参考答案:C
本题解析:
本题难度:一般