微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中电离过程为
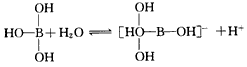
下列判断正确的是 [???? ]
A.凡是酸或碱对水的电离都是抑制的
B.硼酸是三元酸
C.硼酸溶液与NaOH溶液反应的离子方程式:H3BO3+OH-=[B(OH)4]-
D.硼酸是两性化合物
参考答案:C
本题解析:
本题难度:一般
2、填空题 (7分)请根据所学化学知识回答下列问题:
(1)在浓度均为0.1 mol/L ①CH3COONH4、②NH4HSO4、③NH3·H2O、④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)。
(2)氯化铝溶液蒸干,灼烧得到的固体物质是_________,用化学方程式说明其原因:
(3)某温度时蒸馏水的pH=6。将2.3 g金属钠放入该蒸馏水中,充分反应后再加该蒸馏水稀释到1 L,恢复到原温度时所得溶液的pH= 。
参考答案:(1)④>②>①>③(2分);
(2
本题解析:
试题分析:(1)一水合氨为弱电解质,溶液中c(NH4+)最小;相同浓度的铵盐溶液中,NH4+系数越大,c(NH4+)越大,相同系数、相同浓度的铵盐溶液中,NH4+水解程度越大,则溶液中c(NH4+)越小,H+抑制铵根离子水解、CH3COO-促进NH4+水解,所以相同浓度的这几种溶液中c(NH4+)由大到小的顺序为④>②>①>③,故答案为:④>②>①>③。
(2)氯化铝能水解生成氢氧化铝,氯化氢具有挥发性,加热促进氯化氢挥发,从而促进氯化铝水解,则蒸干溶液时得到Al(OH)3固体,灼烧Al(OH)3固体时分解得到Al2O3,反应方程式为,故答案为:Al2O3;Al3++3H2O?Al(OH)3+3 H+、2Al(OH)3 Al2O3+H2O。
Al2O3+H2O。
(3)某温度时蒸馏水的pH=6,则水的离子积常数K=10-12,2.3gNa的物质的量为0.1mol,根据原子守恒得n(NaOH)=n(Na)=0.1mol,则C(NaOH)=0.1mol÷1L=0.1mol/L,溶液中c(H+)=10-11 mol/L,则pH为11。
考点:本题考查离子浓度大小比较、盐类水解、pH的计算。
本题难度:一般
3、选择题 常温下,某溶液中由水电离的c?(H+)=1×10-13mol-L-1,该溶液可能是( )
①氯化铵水溶液???②硝酸钠水溶液???③硫酸水溶液???④氢氧化钠水溶液.
A.①④
B.①②
C.②③
D.③④
参考答案:D
本题解析:
本题难度:简单
4、选择题 已知水的电离平衡曲线如图所示,试回答下列问题:
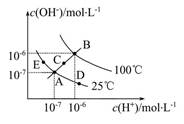
(1)图中五点Kw间的关系是 。
(2)若从A点到D点,可采用的措施是 。
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 。
参考答案:(1)B>C>A=D=E (2)b、
本题解析:(1)Kw只与温度有关,温度升高促进水的电离,Kw增大,因此有B>C>A=D=E。
(2)从A点到D点,溶液由中性转化为酸性,因此选项b和c均符合题意。
(3)25 ℃时所得混合溶液的pH=7,酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)×10-5 mol/L=V(H2SO4)×10-4 mol/L,得V(NaOH)∶V(H2SO4)=10∶1。
本题难度:一般
5、实验题 (6分)某学生用0.100 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,
其操作可分解为如下几步:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(3)判断到达滴定终点的实验现象是 。
参考答案:(1)BDCEAF (2)偏高 (3)溶液由无色变为浅红色并
本题解析:
试题分析:滴定的主要操作步骤有,检漏(检查滴定管是否漏水)、润洗(用标准液润洗滴定管)、装液(往滴定管中注入标准液)、赶气泡(把滴定管中的气泡赶走)、调液面(调节液面在0刻度或0刻度以下)、装待测液加指示剂、滴定记录读数,所以操作顺序为BDCEAF。(2)若先用待测溶液润洗锥形瓶,使得待测液的总量增多,标准NaOH溶液的用量增大,则滴定结果偏高。(3)盐酸中加入酚酞,开始溶液是无色的,达到滴定终点的时候溶液变为弱碱性,酚酞遇碱变红,所以达到终点现象为溶液由无色变为浅红色并在半分钟不不变色。
考点:酸碱中和滴定的操作。
本题难度:一般