微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将同体积同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中的Cl-完全沉淀,则需同物质的量浓度的AgNO3溶液的体积比为
A.1:2:3
B.3:2:1
C.1:1:1
D.6:3:2
参考答案:A
本题解析:分析:先计算同体积同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中的Cl-的物质的量之比,根据Cl-+Ag+=AgCl↓计算需同物质的量浓度的AgNO3溶液的体积比.
解答:计算同体积同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中的Cl-的物质的量之比为:1:2:3,
根据Cl-+Ag+=AgCl↓,可知n(AgNO3)=n(Cl-),
则需同物质的量浓度的AgNO3溶液的体积比为1:2:3,
故选A.
点评:本题考查物质的量浓度的计算,题目难度不大,注意物质的组成特点.
本题难度:困难
2、选择题 质量分数为n的NaOH溶液,其物质的量浓度为amol/L,加热蒸发水使其质量分数变为2n,此时,该溶液中的物质的量浓度为bmol/L,则a与b的关系正确的是
A.b>2a
B.b<2a
C.b=2a
D.a=2b
参考答案:A
本题解析:分析:氢氧化钠溶液浓度越大密度越大,令质量分数为n的NaOH溶液的密度为xg/ml,质量分数为2n的NaOH溶液的密度为yg/ml,根据c=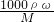 表示质量分数为n的NaOH溶液及质量分数为2n的NaOH溶液的物质的量浓度,据此结合密度x<y判断.
表示质量分数为n的NaOH溶液及质量分数为2n的NaOH溶液的物质的量浓度,据此结合密度x<y判断.
解答:令质量分数为n的NaOH溶液的密度为xg/ml,质量分数为2n的NaOH溶液的密度为yg/ml,则:
质量分数为n的NaOH溶液的物质的量浓度为a=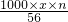 mol/L;
mol/L;
质量分数为2n的NaOH溶液的物质的量浓度为b= mol/L,
mol/L,
氢氧化钠溶液浓度越大,密度越大,所以x<y,故b>2a.
故选A.
点评:本题考查物质的量浓度计算、物质的量浓度与质量分数关系等,难度不大,理解物质的量浓度定义.
本题难度:简单
3、选择题 标准状况下,5.6升NOx气体的质量是7.5克,则x的值为
A.1
B.2
C.3
D.4
参考答案:A
本题解析:分析:利用n=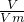 、n×M=m来计算,注意标准状况下为22.4L/mol来解答.
、n×M=m来计算,注意标准状况下为22.4L/mol来解答.
解答:标准状况下,5.6升NOx气体的物质的量为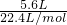 =0.25mol,
=0.25mol,
M=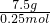 =30,
=30,
由相对分子质量与摩尔质量的数值相等,
则14+16×x=30,
解得x=1,
故选A.
点评:本题考查物质的量的有关计算,明确以物质的量为中心的计算公式即可解答,难度不大.
本题难度:一般
4、选择题 下列实验中操作及现象与结论对应关系正确的一组是
A.A
B.B
C.C
D.D
参考答案: C
本题解析:分析:A、二氧化碳和氯化钡溶液不能发生反应;
B、二氧化硫具有还原性,易被溴单质氧化为硫酸;
C、氯气具有氧化性,能将碘离子氧化为碘单质,碘溶于四氯化碳中显示紫红色;
D、醛和新制氢氧化铜悬浊液的反应需要在碱性环境下才能发生.
解答:A、二氧化碳和氯化钡溶液不能发生反应,只有在碱性环境下才能发生反应生成碳酸钡沉淀,故A错误;
B、二氧化硫具有还原性,易被溴单质氧化为硫酸,溴单质同时被还原为溴离子,而褪色,体现了二氧化硫的还原性,故B错误;
C、氯气具有氧化性,能将碘离子氧化为碘单质,碘溶于四氯化碳中显示紫红色,可以用此现象检验碘离子的存在,故C正确;
D、淀粉和稀硫酸混合共热后,加入过量的氢氧化钠中和硫酸,再加少量新制氢氧化铜悬浊液,如果产生红色沉淀,可以证明淀粉水解可生成葡萄糖,故D错误.
故选C.
点评:本题考查化学实验方案的评价,注意物质的性质和物质的检验方法,排除其它因素的干扰是关键,难度较大.
本题难度:困难
5、选择题 在下列四种溶液中,分别加入少量固体二氧化锰,能产生气体的是
A.3%H2O2溶液
B.1摩/升NaOH溶液
C.1摩/升KClO3溶液
D.1摩/升盐酸
参考答案:A
本题解析:分析:二氧化锰可用作过氧化氢制备氧气的催化剂,与其他三种物质不反应.
解答:A、过氧化氢在二氧化锰作催化剂时可生成氧气,故A正确;
B、二氧化锰与1摩/升NaOH溶液不反应,故B错误;
C、二氧化锰与1摩/升KClO3溶液不反应,故C错误;
D、在加热条件下二氧化锰与浓盐酸反应,与稀盐酸不反应,故D错误.
故选A.
点评:本题考查元素化合物的性质,题目难度不大,注意浓盐酸与二氧化锰的反应.
本题难度:一般