微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某温度下将1molN2和2.5molH2的混合气体通入1L密闭容器中,在一定条件下发生反应,达到化学平衡时,测得混合气体中N2的物质的量为0.2mol.求:
(1)平衡时N2的转化率.
(2)此温度下反应N2(g)+3H2(g)?2NH3(g)的平衡常数.
参考答案:依据化学平衡三段式列式计算;
N2(g)+3H2(g
本题解析:
本题难度:一般
2、选择题 mA(g) + nB(g)  ?pC(g)在同一压强下变化如图,下列叙述正确的是
?pC(g)在同一压强下变化如图,下列叙述正确的是
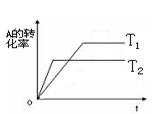
A.T1>T2正反应是吸热反应
B.T1<T2正反应是放热反应
C.T1<T2正反应是吸热反应
D.T1>T2正反应是放热反应
参考答案:B
本题解析:略
本题难度:简单
3、选择题 在恒温、恒容的密闭容器中发生可逆反应: mA(g) + nB(g) pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时, 能说明达到平衡状态的标志是
pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时, 能说明达到平衡状态的标志是
A.体系的压强不再改变
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应
参考答案:D
本题解析:若m+n=p+q,则在反应过程中压强始终是不变的,A错误。混合气的密度是混合气的质量和容器容积的比值,在反应过程中质量和容积均是不变的,即混合气的密度始终是不变的,B不正确。混合气的平均相对分子质量是混合气的质量和混合气的总物质的量的比值,质量不变,气体的总的物质的量也可能是不变的,所以C不一定。选项D中的反应速率方向是相反的,且满足速率之比是相应的化学计量数之比,所以一定能说明。答案选D。
本题难度:一般
4、选择题 将固体NH4I置于密闭容器中,在某温度下,发生反应:
NH4I(气) NH3(气)+HI(气),2HI(气)
NH3(气)+HI(气),2HI(气) H2(气)+I2(气)
H2(气)+I2(气)
当反应达到平衡时,c(H2)=0.5mol/L,c(HI)= 4mol/L,则NH3的浓度为
A.3.5mol/L
B.4.5mol/L
C.4mol/L
D.5mol/L
参考答案:D
本题解析:
试题分析:由氢气的浓度求算分解的碘化氢的浓度,c(HI)= 4mol/L,为剩余的HI浓度,进而求出第一个反应生成的HI:2HI(气) H2(气)+I2(气)
H2(气)+I2(气)
1mol?L?1???0.5mol?L?1? 0.5mol?L?1
NH4I分解共生成HI:1mol?L?1+4mol?L?1=5mol?L?1
NH4I(气) NH3(气)+HI(气)
NH3(气)+HI(气)
5mol?L?1??? 5mol?L?1
NH3的浓度为5mol?L?1,故D项正确。
本题难度:一般
5、计算题 为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示: