微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某恒温密闭容器发生可逆反应Z(?)+W(?)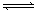 X(g)+Y(?)? ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是
X(g)+Y(?)? ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是

A.Z和W在该条件下一定不为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不相等
C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等
D.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
参考答案:B
本题解析:t2时刻缩小容器体积,增大压强平衡向气体体积减小的方向移动,逆反应速率增大,正反应速率不变说明Z和W一定不是气体,所以A对。由于平衡逆向移动,气体质量减小,平均相对分子质量也减小,B错。由于温度不变化学平衡常数不变,所以C对。反应后气体的量增多,是墒增反应,T0以上能自发进行说明为吸热反应,升温平衡常数增大。
本题难度:一般
2、选择题 .已知在一定条件下有CO(g)+H2O(g)  ?CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)
?CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=a kJ/mol,反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g) ΔH=a kJ/mol,反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
A.反应放出的热量为0.04a KJ
B.平衡时H2O的转化率为40%
C.若将容器的体积压缩为1 L,有利于该反应平衡正向移动
D.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
参考答案:B
本题解析:CO(g)+H2O(g)  ?CO2(g)+H2(g),
?CO2(g)+H2(g),
0.2 mol??0.2 mol??? 0????? 0
X??????? X??????? X?????? X
0.2-X?????? 0.2-X?????? X??????? X
c(CO)∶c(CO2)=3∶2, ( 0.2-X):X=3:2?? X=0.08
Q=0.08a KJ /平衡时H2O的转化率为40%
若将容器的体积压缩为1 L,有利于该反应平衡不移动。各组分的浓度不变才是平衡状态的标志。
本题难度:一般
3、选择题 将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应 NO?2(g)+CO(g) CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是(???)
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是(???)
A.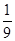
B.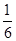
C.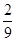
D.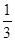
参考答案:
本题解析:C
试题分析:????? NO?2(g)+CO(g) CO2(g)+NO(g)
CO2(g)+NO(g)
起始量(mol)?? 1????? 1???????? 0????? 0
转化量(mol)?? 0.5??? 0.5?????? 0.5??? 0.5
平衡量(mol)?? 0.5??? 0.5?????? 0.5??? 0.5
则平衡常数K=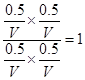
NO?2(g)+CO(g) CO2(g)+NO(g)
CO2(g)+NO(g)
起始量(mol)?? 1????? 2???????? 0????? 0
转化量(mol)?? x????? x???????? x????? x
平衡量(mol) (1-x)(2-x)??? x????? x
则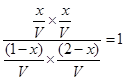
解得x=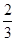
所以反应达到化学平衡时,混合气体中CO2的体积分数是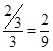
答案选C。
点评:该题是基础性试题的考查,难度不大。该题学生需要明确的是做这类试题的基本要求,即在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。该题有利于培养学生的规范答题能力。
本题难度:简单
4、填空题 在一定体积的密闭容器中,进行化学反应CO2 (g)+H2 (g) CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表: