微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有0.1 mol 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.溶液①中,C(CH3COO-)=C(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的C(CH3COO-)
C.溶液①、②等体积混合,混合液中c(CH3COO-)+ c(CH3COOH)= C(Na+)
D.溶液①、③等体积混合,混合液中C(Na+)>C(CH3COO-)> C(H+)>C(OH-)
参考答案:C
本题解析:
试题分析:A、溶液①中,醋酸电离产生的C(CH3COO-)=C(H+),但溶液中的C(CH3COO-)<C(H+),错误;B、溶液①、②等体积混合,混合液的CH3COONa的浓度为0.05 mol ,所以混合液中c(CH3COO-)小于溶液③中的C(CH3COO-),错误;C、溶液①、②等体积混合,
,所以混合液中c(CH3COO-)小于溶液③中的C(CH3COO-),错误;C、溶液①、②等体积混合,
本题难度:一般
2、实验题 (12分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图。

该实验的主要操作步骤如下:
a.配制浓度均为1 mol·L-1盐酸和醋酸溶液;
b.用 ①?量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
c.分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ② g;d.在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;e.将铜丝向下移动,使足量镁带浸入酸中,至反应完全,记录 ③ ;
f.反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ④ ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:????
(1)用文字表述d检查该装置气密性的操作与观察方法: ⑤ 。
(2)本实验中应选用 ⑥ (填序号)的量筒。
A.100 mL???????? B.200 mL???????? C.500 mL
(3)简述速率不等的原因 ⑦ ,铜丝不与酸接触的原因是 ⑧ 。
参考答案:①酸式滴定管 (1分) ② 0.12 (2分)③反应时间 (
本题解析:
试题分析:量取10.00 mL1 mol·L-1由于要准确量取,所以用酸式滴定管或者移液管都行
分别称取除去表面氧化膜的镁带a g,要保证足够反应,氢离子和镁的反应定量关系是2:1,所以镁至少是0.10mol?质量至少0.12g ;将铜丝向下移动,使足量镁带浸入酸中,至反应完全,记录反应时间。? f.反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应将量筒缓缓向下移动,使乙、丙中液面相平;检查该装置气密性的操作与观察方法:两手掌紧贴锥形瓶外壁一会,如观
本题难度:困难
3、选择题 甲酸(HCOOH)的下列性质中,可以证明它是弱电解质的是( )
A.1mol/L的甲酸溶液的pH约为2
B.甲酸能与水以任意比例互溶
C.10mL1mol/L甲酸恰好与10mL1mol/LNaOH溶液完全反应
D.在相同条件下,甲酸的导电性比一元强酸溶液的弱
参考答案:A.1mol/L的甲酸溶液的pH约为2,则甲酸溶液中氢离子浓
本题解析:
本题难度:一般
4、选择题 下列关于电解质溶液的叙述正确的是?(????? )
A.室温下,pH=3的氢氟酸加水稀释后,电离常数Ka(HF)和pH均减小
B.室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
C.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中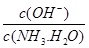 增大
增大
D.室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色
参考答案:D
本题解析:
试题分析:A、加水稀释,酸性会减弱,PH会变大,故A错误;B、PH=7,溶液呈中性,氢离子浓度等于氢氧根离子的浓度且,c(SO42-)=c(NH4+),故B错误;C、加入氯化铵抑制氨水的电离,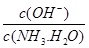 减小,故C错误。故选D。
减小,故C错误。故选D。
点评:本题考查学生溶液中离子浓度之间的守恒关系以及离
本题难度:简单
5、填空题 已知:某种硫酸盐(MSO4)难溶于水,也难溶于硝酸溶液,却可以溶解于某种铵盐溶液中(NH4B),形成无色的溶液。在所形成的无色溶液中通入H2S气体,有黑色沉淀生成(已知HB是一种易溶于水的弱电解质),有关离子方程式可表示为(未知离子可用M2+、B-表示)
___________________________________
参考答案:MSO4+2B-=MB2+SO42-;MB2+H2S=MS↓
本题解析:
本题难度:一般