微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在容积一定的密闭容器中发生可逆反应A(g)+2B(g) 2C(g);△H>0,平衡移动关系如下图所示。下列说法正确的是
2C(g);△H>0,平衡移动关系如下图所示。下列说法正确的是
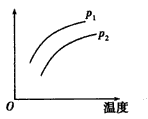 [???? ]
[???? ]
A.p1<P2,纵坐标指A的质量分数
B.p1>P2,纵坐标指C的质量分数
C.p1<P2,纵坐标指A的转化率
D.p1<P2,纵坐标指混合气体的平均摩尔质量
参考答案:B
本题解析:
本题难度:一般
2、选择题 在密闭容器中有反应mA(g)+nB(g)?pC(g)(正反应吸热)处于平衡状态,已知m+n>p,则下列说法正确的是( )
①升温时c(B)/c(C)比值减小②充入C,则A、B的物质的量增大
③充入B,则A的转化率变大④加入催化剂,气体的总物质的量不变.
A.①②
B.②③
C.③④
D.①②③④
参考答案:①正反应为吸热反应,升高温度平衡向正反应方向移动,B的物质的
本题解析:
本题难度:一般
3、填空题 H2O由液态变为气态的过程可以用下式来表示:
H2O(l) H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O
H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O 的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题:
的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题:
(1)减小压强,平衡向??????移动。所以高山上由于空气稀薄,水的沸点比平地上
??????(填高或 低)。高压锅中水的沸点比普通锅中水的沸点??????(填高或低)。
低)。高压锅中水的沸点比普通锅中水的沸点??????(填高或低)。
参考答案:右??低???高
本题解析:略
本题难度:简单
4、填空题 (14分)二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
①CO(g) + 2H2(g) CH3OH(g) △H1=-Q1 kJ·mol-1
CH3OH(g) △H1=-Q1 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) + 2H2(g) CH3OH (g) △H
CH3OH (g) △H
下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。