微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一个固定容积的密闭容器中,加入a molA、b molB,发生aA(g)+bB(g) pC(g),且a+b≠p,则处于平衡状态的标志是
pC(g),且a+b≠p,则处于平衡状态的标志是
A.c(A)=c(B)=c(C)
B.单位时间消耗a molA同时消耗b molB
C.混合气体的压强保持不变
D.混合气体的密度保持不变
2、选择题 现有如下四个图象下列反应中全部符合上述图象的反应是

[???? ]
A.N2(g)+3H2(g)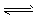 2NH3(g)ΔH=-Q1 kJ/mol(Q1>0)
2NH3(g)ΔH=-Q1 kJ/mol(Q1>0)
B.H2(g)+CO(g)  C(s)+H2O(g)ΔH=+Q4 kJ/mol(Q4>0)
C(s)+H2O(g)ΔH=+Q4 kJ/mol(Q4>0)
C.4NH3(g)+5O2(g)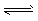 4NO(g)+6H2O(g)ΔH=-Q3 kJ/mol(Q3>0)
4NO(g)+6H2O(g)ΔH=-Q3 kJ/mol(Q3>0)
D.2SO3(g)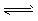 2SO2(g)+O2(g)ΔH=+Q2 kJ/mol(Q2>0)
2SO2(g)+O2(g)ΔH=+Q2 kJ/mol(Q2>0)
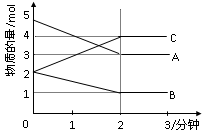
3、填空题 (12分)某可逆反应从0—2分钟进行过程中, 在不同反应时 间各物质的量的变化情况如下图所示。则该反应的的反应物是 ,生成物是 ,化学方程式为 ;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____ ,若不能,则其原因为 _ ________________ ;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态。
4、填空题 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:
2CO(g)+O2(g)=2CO2(g)??△H=-566kJ/mol?
2Fe(s)+3/2O2(g)=Fe2O3(s)?△H=-825.5?kJ/mol
反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)??△H=_______kJ/mol。
2Fe(s)+3CO2(g)??△H=_______kJ/mol。
II.反应?1/3Fe2O3(s)+CO(g)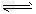 2/3?Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。
2/3?Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。
(1)CO的平衡转化率=?_____________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度????b.增大反应体系的压强 c.选取合适的催化剂???
d.及时吸收或移出部分CO2? e.粉碎矿石,使其与平衡混合气体充分接触
III.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
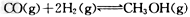 ??。请根据图示回答下列问题:
??。请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率?(H2)=?________。
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表
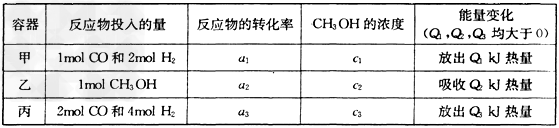
则下列关系正确的是________。
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1?+a2?=1
E.该反应若生成1mol?CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l?molCO、2mol?H2和1mol?CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动。
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式__________________。
5、填空题 (11分)化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
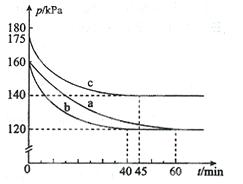
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 。