微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一个恒容绝热的密闭容器中,发生可逆反应:M(?) + 2N(g) P(g) + Q(g) △H>0 ,已知M的状态未知,则下列描述一定达到平衡的标志是
P(g) + Q(g) △H>0 ,已知M的状态未知,则下列描述一定达到平衡的标志是
①当物质M、N、P的体积分数比为 1 : 1 : 1时
②混合气体的密度不变时
③体系的温度不变时
④反应速率2v (N)正=v (Q)逆时
⑤体系的压强不变时
⑥气体的平均相对分子质量不变时
A.①③④
B.③⑥
C.②③⑥
D.③④⑤
参考答案:B
本题解析:
试题分析:从平衡状态的两个重要特征判断:①v正=v逆,②混合物中各组成成分的百分含量不变。①当物质M、N、P的体积分数比为 1 : 1 : 1时,并不能说明各组分的浓度保持不变,错误;②在恒容、密闭容器中,若M是气体,混合气体的密度始终不变,不能说明,错误;③该反应是吸热反应,随着反应的进行,体系的温度降低,当体系的温度不变时,达到平衡,正确;④反应速率2v (N)正=v (Q)逆时,速率之比不等于系数之比,错误;⑤若M是固体,反应前后气体的化学计量数之和相等,压强始终不变,错误;⑥若M是气体,反应前后气体的化学计量数之和不相等,若M是固体,反应前后气体的质量不相等,当达到平衡时,混合气体的平均摩尔质量不再改变,正确;选B。
考点:考查化学平衡状态的判断。
本题难度:困难
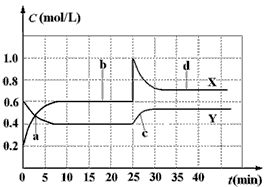
2、选择题 已知NO2和N2O4可以相互转化:2NO2(g) 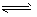 N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
 [???? ]
[???? ]
A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4
D.若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积
参考答案:C
本题解析:
本题难度:一般
3、选择题 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:

其中第①步中存在平衡:2CrO42- (黄色)+2H+
参考答案:
本题解析:
本题难度:一般
4、填空题 (16分)已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
反应②: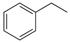 (g)
(g)
 (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
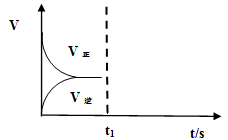
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请画出t1之后的正逆反应曲线,并作出标注。
(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)="0.125" mol/L,则2NO2(g) N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
(4)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表: