微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在。研究表明可采用双氧水氧化法处理电镀含氰废水。某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应)。
【查阅资料】
①Cu2+可作为双氧水氧化法废水处理过程中的催化剂;
②Cu2十在偏碱性条件下对双氧水分解影响较弱,可以忽略不计;
③[Fe(CN)6]3-较CN一难被双氧水氧化,pH越大,[Fe(CN)6]3-越稳定,越难被氧化。
[实脸设计]
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号
| 实验目的
| 初始pH
| 废水样品体积mL
| CuSO4溶液的体积/mL
| 双氧水溶液的体积/mL
| 蒸馏水的体积mL
|
①
| 为以下实验作参考
| 7
| 60
| 10
| 10
| 20
|
②
| 废水的初始pH对破氰反应速率的影响
| 12
| 60
| 10
| 10
| 20
|
③
|
|
|
|
|
| 10
【数据处理]
实验测得含氰废水中的总氰浓度(以CN一表示)随时间变化关系如下图所示。

(2)实验①中20——60 min时间段反应速率v(CN-)= ____mol·L-1?min-1。
【解释和给论]
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是______
(填一点即可)。
在偏碱性条件下,含氰废水中的CN一最终被双氧水氧化为HCO3- ,同时放出NH3,试写出该反应的离子方程式:
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实脸并验证上述结论,完成下表中内容。
(己知:废水中的CN一浓度可用离子色谱仪测定)
实验步骤(不要求写出具体操作过程)
| 预期实验现象和结论
|
|
2、选择题 已知反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,下列各组实验中最先出现浑浊的是[???? ]
| 温度 | Na2S2O3 | H2SO4
H2O
体积
浓度
体积?
浓度
体积
A.
0℃????
10mL
0.1?mol/L
10mL
0.1?mol/L
0mL
B.
10℃????
5mL
0.1?mol/L
5mL
0.1?mol/L
10mL
C.
30℃????
5mL
0.1?mol/L
5mL
0.1?mol/L
10mL
D.
30℃???
5mL
0.2?mol/L
5mL
0.2?mol/L
10mL
3、选择题 某温度下,在一密闭容器中发生如下可逆反应:2E(g)?F(g)+xG(g);△H<0.若起始时E浓度为a?mol?L-1,F、G浓度均为0,达平衡时E浓度为O.5a?mol?L-1;若E的起始浓度改为?2a?mol?L-1,F、G浓度仍为O,当达到新的平衡时,下列说法正确的是( )
A.升高温度时,正反应速率加快、逆反应速率减慢
B.若x=l,容器体积保持不变,新平衡下E的体积分数为50%
C.若x=2,容器体积保持不变,新平衡下F的平衡浓度小于0.5a?mol?L-1
D.若x=2,容器压强保持不变,新平衡下E的物质的量为a?mol
4、选择题 下列措施能减慢化学反应速率的是
A.将煤块粉碎后燃烧
B.用2mol/L的盐酸代替0.1mol/L的盐酸反应制氢气
C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末
D.将食物贮藏在冰箱中
5、选择题 对于可逆反应,A2(g)+3B2(g)?2AB3(g)△H<0,下列图象不正确的是( )
A.
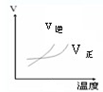
B.

C.
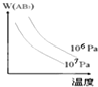
D.
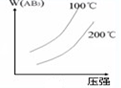
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772