微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
A.反应混合物的浓度
B.反应体系的压强
C.反应物的转化率
D.正、逆反应的速率
参考答案:C
本题解析:
试题分析:对于一个前后气体系数不变的反应,当反应达到平衡时,增大体积,各物质浓度减小、压强减小,但是反应物和生成物的浓度变化相同,所以平衡不移动,所以A、B错误;若加入催化剂,正逆反应速率同倍数增大,所以平衡也不移动,D错误;若反应物的转化率变化,则平衡一定移动,故选C。
本题难度:一般
2、填空题 某化学反应2A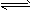 B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表
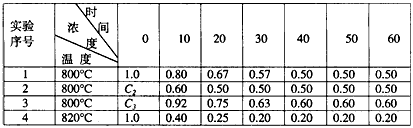
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为___________mol/(L·min)。
(2)在实验2,A的初始浓度C2=___________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是______________________。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3______V1(填“<”“>”“=”),且C3
_______1.0mol/L(填“<”“>”“=”)。
(4)比较实验4和实验1,可推测该反应是_________反应(选填“吸热”或“放热”),理由是______________________。
参考答案:
(1)0.013
(2)1.0;催化剂
本题解析:
本题难度:一般
3、选择题 一定温度下,可逆反应H2(g)+I2(g) 2HI(g)达到化学平衡状态的标志是(?)
2HI(g)达到化学平衡状态的标志是(?)
A.混合气体的压强不再变化
B.混合气体的颜色不再变化
C.反应速率v(H2)="0.5v" (HI)
D.c (H2):c(I2):c(HI)=1:1:2
参考答案:B
本题解析:
试题分析:判断一个反应是否达到平衡状态的实质是正逆反应速率相等,标志是所给条件是否从“变”达到“不变”。A该反应气体分子总数前后一样,故压强始终不变;B碘蒸气为紫色,随着反应的进行,容器内气体的颜色逐渐变浅;C反应速率之比始终与化学计量系数之比相等,故不能用于判断反应是否达到平衡状态;D各物质的浓度之比与化学计量系数之比相同,与反应是否达到平衡无关系。故答案选B。
点评:判断一个反应是否达到平衡状态,是历年高考的重点。考生在备考过程中应抓住实质、通过标志进行分析。难度中等,一般以选择题出现。
本题难度:一般
4、填空题 (12分)在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g)?? ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g)?? ΔH <0,n(O2)随时间的变化如图实线所示:

(1)用SO2表示0~4 min内该反应的平均速率为???????????????。该温度下反应的平衡常数K为??????????。升高温度K值????????(填“增大”、“不变”或“减小”)。??
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度???????
(填“增大”、“不变”或“减小”),氧气的转化率???????????(填“升高”、“不变”或“降低”),SO3的体积分数???????????(填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
参考答案:(1)0.025 mol/(L·min)(2分)?? 20(
本题解析:(1)化学反应速率通常用单位时间内浓度的变化量来表示。0~4 min内氧气减少了0.1mol,则同时消耗二氧化硫是0.2mol,所以用SO2表示0~4 min内该反应的平均速率为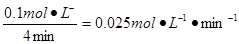 。平衡是容器内氧气、二氧化硫、三氧化硫的浓度分别是0.05mol/L、0.1mol/L、0.1mol/L,所以平衡常数是
。平衡是容器内氧气、二氧化硫、三氧化硫的浓度分别是0.05mol/L、0.1mol/L、0.1mol/L,所以平衡常数是 。因为反应是放热反应,所以温度升高平衡向逆反应方向移动,即平衡常数减小。
。因为反应是放热反应,所以温度升高平衡向逆反应方向移动,即平衡常数减小。
(2)再加入1mol氧气,氧气浓度增大,平衡向正反应方向移动,提高二氧化硫的转化率,所以SO2的平衡浓度将减小,但氧气的转化率将减小。根据(1)可计算出平衡时二氧化硫的体积分数是40%。通入1mol氧气,若二氧化硫全部生成三氧化硫才是0.4mol,此时其体积分数是2/7,所以其体积分数减小。
(3)曲线I和原来相比,达到平衡的时间少了,但氧气的转化率降低了,所以只能是升高温度。曲线Ⅱ和原来相比,达到平衡的时间也少了,但氧气的转化率增大了,所以只能是增大压强。
本题难度:简单
5、选择题 N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)  4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
T1温度下的部分实验数据为:
t/s
| 0
| 500
| 1000
| 1500
|
c(N2O5)/mol·L-1
| 5.00
| 3.52
| 2.50
| 2.50
下列说法不正确的是
A.500 s内N2O5分解速率为2.96×10-3 mol·(L·s)-1
B.T1温度下的平衡常数为K1=125, 1000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
参考答案:C
本题解析:
A、500 s内N2O5分解速率=(5.00-3.52)mol·L-1/500 s=2.96×10-3 mol·(L·s)-1,故正确;
B、分析表中数据,得:1000 s时达平衡;?? 2N2O5(g)  4NO2(g)+O2(g) 4NO2(g)+O2(g)
C(初始)???? 5.00????????? 0?????? 0
△C??????? 2.50???????? 5.00????? 1.25
C(平衡)2.50???????? 5.00?????? 1.25
K1=([NO2]4[O2])/[ N2O5]2 ,代入数据,得:K1=125
1000 s时转化率="2.50/5.00=50%" ,故正确;
C、T1温度下反应到1000 s时测得N2O5(g)浓度为2.50 mol·L-1,
T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,
即:T1到T2,N2O5(g)浓度的增大,平衡逆向移动,逆向为放热的,则T1>T2,故错误;
D、K1>K3,说明(T1到T3)K值减小,平衡逆向移动,逆向为放热的,则T1>T3,故正确
本题难度:一般
|