微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业废水中常含有Cu2+、Cd2+、Pb2+等重金属离子,可通过加入过量的难溶电解质FeS、MnS,使这些金属离子形成硫化物沉淀除去。根据以上事实,可推知FeS、MnS具有的相关性质是 [???? ]
A.在水中的溶解能力大于 CuS、CdS、PbS
B.在水中的溶解能力小于CuS、CdS、PbS
C.在水中的溶解能力与CuS、CdS、PbS相同
D.二者均具有较强的吸附性
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.根据Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=1.12×10-12,可以推知AgCl的溶解度比Ag2CrO4的溶解度大
B.0.1mol·L-1的ZnCl2溶液中通入足量硫化氢气体,最终得不到ZnS沉淀。是因为溶液中c(Zn2+)·c(S2-)>Ksp(ZnS)
C.向硫酸钡沉淀中加入碳酸钠溶液,沉淀发生转化,据此可推知碳酸钡的Ksp比硫酸钡的小
D.AgCl在10mL 0.05mol·L-1的KCl溶液中比在20mL0.01mol·L-1的AgNO3溶液中溶解的质量少
参考答案:D
本题解析:因为氯化银和铬酸银的阴阳离子个数比不同,所以不能直接根据溶度积常数大小来比较溶解度大小。因为ZnS能溶于盐酸中,如果发生反应生成ZnS的同时,必然有盐酸生成,所以是不可能的。沉淀能否转化,关键是溶液中的离子积是否大于溶度积常数,C是错误的。氯化钾溶液中氯离子浓度大于硝酸银溶液中银离子的浓度,所以溶解的氯化银少,即D是正确的,答案选D。
本题难度:一般
3、填空题 (8分)工业上为了处理有Cr2O72—的酸性废水,采用下面的处理方法:往工业废水里加入适量的NaCl,以Fe为电极进行电解,经过一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中Cr3+的浓度若低于10—5mol/L可符合排放标准。回答下列问题:
(1)电解时阳极上发生的电极反应式: ;
(2)写出Cr2O72—变为Cr3+的离子方程式 ;
(3)工业废水由酸性变为碱性的原因是 ;
(4)已知室温下Cr(OH)3的KSP=1×10—32,则该温度下符合排放标准的溶液的最低pH为 。
参考答案:(1)阳极:Fe—2 e— = Fe2+ (2)C
本题解析:
试题分析:(1)铁是活性电极,所以阳极是铁失去电子,电极反应式是Fe-2e-="=" Fe2+;
(2)由于生成亚铁离子具有还原性,能把Cr2O72-还原为Cr3+。所以该反应的离子方程为Cr2O72— + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O;
(3)由于H+不断放电,同时Cr2O72-与Fe2+反应时消耗H+,从而打破了水的电离平衡,所以工业废水由酸性变为碱性的原因是阴极上H+放电,Cr2O72—与Fe2+反应不断消耗H+,使水 的电离平衡正向移动;
(4)室温下Cr(OH)3的KSP=1×10—32,工业废水中Cr3+的浓度若低于10—5mol/L可符合排放标准,则10—5mol/L×[OH-]3=1×10—32,解得[OH-]=10-9mol/L,PH=5。
考点:考查电解原理的应用。
本题难度:一般
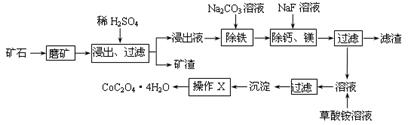
4、填空题 (15分)某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:
 ????
????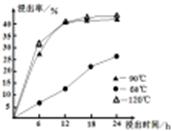
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为????????小时,最佳的浸出温度为?????????℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+?H2O+?Na2CO3=?Na2Fe6(SO4)4(OH)12↓+??Na2SO4+??CO2↑???
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)=???????????。
(4)“沉淀”中含杂质离子主要有????????????????????;“操作X”名称为?????????????。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为?????价。若放电时有1mole-转移,正极质量增加???g。
CoO2+ LiC6。LiC6中Li的化合价为?????价。若放电时有1mole-转移,正极质量增加???g。
参考答案:(1)12 ; 90 ;???(2)3,6,6,1,5,6;
本题解析:
试题分析:(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。由图可知:温度越高,浸出率越高,时间越长,浸出率。但是考虑生产成本和效率,最佳的浸出时间为12小时;最佳的浸出温度为90 ℃;(2)用化合价升降法配平化学方程式为3Fe2(SO4)3+6H2O+6Na2CO3= Na2Fe6(SO4)4(OH)12↓+ 5Na2SO4+ 6CO2↑;(3)KSP(CaF2)= c(Ca2+)×c2(OH-)=1.11×10-10; KSP(MgF2)= c(Mg2+) ×c2(O
本题难度:一般
5、选择题 已知Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是[???? ]
A.AgCl不溶于水,不能转化为AgI
B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于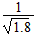 ×10-11mol·L-1?
×10-11mol·L-1?
参考答案:A
本题解析:
本题难度:一般