微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,某溶液中由水电离产生的C(H+)和C(OH-)的乘积为1×10-20,下列说法正确的是
A.该溶液的pH一定是10
B.该溶液不可能pH="4"
C.该溶液的pH不可能是7
D.不会有这样的溶
参考答案:C
本题解析:由题意可知由水电离的C(H+)=C(OH-)=1×10-10mol/L<1×10-7mol/L,说明水的电离受抑制,可能是酸溶液也可能是碱溶液
当是酸溶液时,溶液中的OH-全部来自于水的电离,溶液中的C(H+)=1×10-4mol/L,pH=4
当是碱溶液时,溶液中的H+全部来自于水的电离,溶液中的C(H+)=1×10-10mol/L,pH=10
故答案为C
本题难度:一般
2、选择题 25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )

A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
参考答案:A
本题解析:在A点是20 mL 0.1 mol·L-1 NaOH溶液和10 mL 0.2 mol·L-1醋酸溶液恰好反应完全,生成的醋酸钠中的醋酸根离子水解使溶液呈碱性,离子浓度的关系应该为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A项错误;B点时溶液为中性,c(OH-)=c(H+),由电荷守恒可得c(CH3COO-)=c(Na+),B项正确;在C点,CH3COOH过
本题难度:一般
3、实验题 (14分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
(1)锥形瓶中的溶液从_____色变为_____色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应注视________????????_;
(3)该小组在步骤①中的错误是_?????????????????___,由此造成的测定结果_____(填偏高、偏低或无影响);
(4)步骤②缺少的操作是_______????????___;
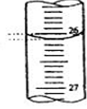
(5)如图,是某次滴定时滴定管中的液面,其读数为????????mL
(6)根据下列数据:
滴定次数
| 待测液体(mL)
| 标准盐酸体积(mL)
|
滴定前读(mL)
| 滴定后读数(mL)
|
第一次
| 25.00
| 0.50
| 20.40
|
第二次
| 25.00
| 4.00
| 24.10
|
第三次
| 25.00
| 0.80
| 23.10
请选用合理的数据计算待测烧碱溶液的浓度为_______?mol/L
(7)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_____;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥?????????????? ???????????????????
C.酸式滴定管在滴定前有气泡,滴定后气泡消失????????????????????????????????
D.读取盐酸体积时,滴定结束时俯视读数
参考答案:(1)红(1分)无(1分)(2)锥形瓶内溶液颜色的变化(2分
本题解析:(3)用待测溶液润洗锥形瓶,致使氢氧化钠的总量增大,则消耗盐酸的体积增大,故测定结果偏高;
(5)滴定管,读到0.01 mL;
(6)三次消耗盐酸的体积依次为:19.90mL、20.10mL、22.30mL,第3次误差较大,故取前两次的平均值,得:V(HCl)="20.00" mL,代入c(NaOH)V(NaOH)= c(HCl)V(HCl),得:c(NaOH)=" 0.0800" mol/L
(7)c(NaOH) =" [c(HCl)V(HCl)]/" V(NaOH),所有操作都归结到
本题难度:一般
4、选择题 常温时,将V1mL c1 mol/L的氨水滴加到V2mL c2 mol/L的盐酸中,下列正确的是????
A.若混合溶液的pH=7,则溶液中c (NH4+)> c (Cl—)
B.若V1=V2,c1=c2,则溶液中一定存在c(H+)=c (OH—),呈中性
C.若混合溶液的pH=7,则一定存在c1V1>c2V2 关系
D.若V1=V2,并且混合液的pH<7,则一定是由于盐酸过量而造成的
参考答案:C
本题解析:相关反应:NH3-H2O?? +?? HCl?? =?? NH4Cl? +? H2O
根据电荷守恒? c(NH4+) + c(H+)=" c" (Cl-)? +? c(OH-)
?如果两者完全反应,那么产物氯化铵为弱碱强酸盐,水解呈酸性,pH值应该小于7。
?如pH值为7,所以 c(H+)=? c(OH-)?,可以得出 c(NH4+)=" c" (Cl-) ;如pH值为7,说明氨水加的量多了一点,抑制了铵根离子的水解,溶液才可能为7.所以得出C1V1>C2V2。
答案选C。
本题难度:简单
5、选择题 向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示。下列判断正确的是( )??
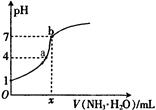 ? ?
A.x=20
B.稀H2SO4的浓度为0.10mol/L
C.b点有:2c(NH4+) = c(SO42-)> c(H+) = c(OH-)
D.a点有:c(NH4+) < 2c(SO42-)
参考答案:D
本题解析:
试题分析:图中稀硫酸的pH为1,则其浓度为0.05mol/L,B错误;氨水为弱碱,部分电离,若x=20,则此时溶液为酸性,A错误;b点时,溶液呈中性,故c(H+) = c(OH-),而c(NH4+) ="2" c(SO42-),故C错误;b点时,溶质为硫酸铵,c(NH4+) :c(SO42-)=2:1,故a点有:c(NH4+) < 2c(SO42-),D正确。
点评:弱电解质的电离是历年高考的重点,难度较大,考生在备考过程中应注意积累各个知识点的考查形式。
本题难度:一般
|