微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室为了制取干燥的氨气,下列方法中适合的是(?)
A.NH4Cl和H2SO4(浓)混合加热,生成的气体用碱石灰干燥
B.N2 + H2→ NH3,用烧碱干燥
C.氯化铵和氢氧化钙固体混合加热,气体用碱石灰干燥
D.向浓氨水中加入生石灰,气体用P2O5干燥
参考答案:C
本题解析:
正确答案:C
A、得不到氨气,生成HCl气体;
B、是工业制氨气;
C、正确;
D、不能用酸性干燥剂。
本题难度:简单
2、实验题 在实验室里用乙醇和浓硫酸反应生成乙烯,再用溴与乙烯反应生成1,2-二溴乙烷,可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。有关数据列表如下:
?
| 乙醇
| 1,2二溴乙烷
| 乙醚
|
状态
| 无色液体
| 无色液体
| 无色液体
|
密度/g·cm-3
| 0.79
| 2.2
| 0.71
|
沸点/℃
| 78.5
| 132
| 34.6
|
熔点/℃
| -130
| 9
| -116
(1)用下列仪器制备1,2-二溴乙烷。如果气体流向为从左到右,则正确的连接顺序是(短接口或橡皮管均已略去): 经A(1)插入A中, 接A(2),A(3)接 接 接 接 (填大写字母代号)。

(2)温度计水银球的正确位置是 。
a、支管口处?????????? b、液面上方 c、液面以下
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a、水 b、氢氧化钠溶液 c、碘化钠溶液 d、乙醇
(6)若产物中有少量副产物乙醚,可用 的方法除去;
(7)反应过程中应用冷水冷却装置E,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
参考答案:(9分)
(1)B D C F E G
本题解析:
试题分析:在分析过程中主要抓住两点:其一是必须除去混在乙烯中的气体杂质,尤其是SO2气体,以防止SO2与Br2发生反应SO2+Br2+2H2O 2HBr+H2SO4,影响1,2-二溴乙烷产品的制备。其二是必须在理解的基础上灵活组装题给的不太熟悉的实验仪器(如三颈烧瓶A、恒压滴液漏斗D、安全瓶防堵塞装置C),反应管E中冷水的作用是尽量减少溴的挥发,仪器组装顺序是:制取乙烯气体(用A、B、D组装)一安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G)”。 2HBr+H2SO4,影响1,2-二溴乙烷产品的制备。其二是必须在理解的基础上灵活组装题给的不太熟悉的实验仪器(如三颈烧瓶A、恒压滴液漏斗D、安全瓶防堵塞装置C),反应管E中冷水的作用是尽量减少溴的挥发,仪器组装顺序是:制取乙烯气体(用A、B、D组装)一安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G)”。
点评:本题考查的是乙烯的制备及反应的相关知识,题目难度大,注意题中信息的分析及其利用。
本题难度:一般
3、选择题 关于下列各实验装置的叙述中,不正确的是
 [???? ] [???? ]
A.装置①可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C.装置③可用于干燥、收集NH3,并吸收多余的NH3
D.装置④可用于分离C2H5OH和H2O的混合物
参考答案:D
本题解析:
本题难度:一般
4、选择题 下图装置可用于
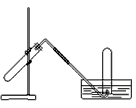
A.用氯酸钾和少量二氧化锰,制取氧气
B.用NH4Cl与Ca(OH)2,制取NH3
C.用Cu和浓HNO3反应制取NO2
D.用Cu和稀HNO3反应制NO
参考答案:D
本题解析:
试题分析:固体混合物加热制取气体,试管口要略向下倾斜。A.B.错误。C.用Cu和浓HNO3反应制取NO2由于NO2容易溶解在水中,所以不能用排水法来收集。错误。D.用Cu和稀HNO3反应制NO。NO不容易溶解在水中,可以用排水法来收集。正确。3、NO2、NO等气体的实验室制法的装置、收集等实验知识。
本题难度:一般
5、实验题 (15分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
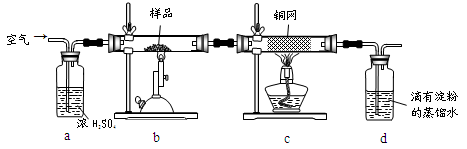
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的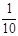 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题: 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______?。
(2)装置a和c的作用分别是____和____(填标号)。
A除去SO2气体????????? B除去空气中的水蒸气???? C有利于气体混合
D有利于观察空气流速?? E除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4) 通过计算可知,该黄铜矿的纯度为________。
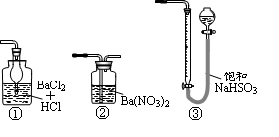
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
参考答案:(1)电子天平,使原料充分反应、加快反应速率。????(2)
本题解析:
试题分析:(1)由于托盘天平的准确度为0.1g,但是要称量的质量是1.150g。因此称量样品所用的仪器为电子天平;将样品研细后再反应,其目的是增大接触面积,使原料充分反应、加快反应速率。(2)装置a的作用是除去空气中的水蒸气;混合气体,有利于观察空气流速,因此选项为BD;装置c的作用除去反应后多余的氧气。选项为E。(3)上述反应结束后,仍需通一段时间的空气,其目的是使反应生成的SO2全部进入d装置中,使结果精确。(4)SO2与碘水反应的方程式是I2+SO2+2H2O=H2SO4+2HI。根据元素守恒可得CuFeS2~2SO2~2I2,n(I2)= 0.05mol/L×0.02L×10=0.01mol.所以n(CuFeS2)=0.005mol;m(CuFeS2)= 0.005mol×184g/mol=0.92g,所以该黄铜矿的纯度为(0.92g÷1.150g)×100%=80%。(5)①与SO2不能发生反应,不能吸收。错误,②能够吸收SO2的装置。正确。③是用来测量气体体积的,不能用来吸收气体。错误。(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有空气中的CO2与Ba(OH)2反应生成BaCO3沉淀;BaSO3被氧化成BaSO4。
本题难度:一般
|