微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 阅读下面三段材料:
①早在1785年,卡文迪许在测定空气组成时,除去空气中的O2、N2等已知气体后,发现最后总是留下一个体积不足总体积1/200 的小气泡。
②1892年,瑞利在测定氮气密度时,从空气中得到的氮气密度为1.2572g/L, 而从含氮化合物分解得到的氮气密度为1.2508g/L。两者相差0.0064g/L。
③瑞利和拉姆赛共同研究后认为:以上两个实验中的 “小误差”可能有某种必然的联系,并预测大气中含有某种较重的未知气体。经反复实验,他们终于发现了化学性质极不活泼的惰性气体——氩。
请回答下列问题:
(1)材料①、②中的“小误差”对测定空气组成和氮气密度的实验而言是主要因素还是次要因素?
(2)材料③中科学家抓住了“小误差”而获得重大发现说明了什么问题?
参考答案:(1)次要因素;(2)科学研究应有严谨的科学态度。
本题解析:(1) “小误差”对测定空气的主要成分而言是次要因素,对氮气的密度影响很小,也是次要因素。但对空气所有成分的测定来说是绝不能忽略的主要因素之一。(2)只要有误差,就会有误差产生的原因,找出产生误差的原因,可能会有重大的发现。科学一定要严谨。
本题难度:简单
2、实验题 下列装置为中学化学实验常用的气体制备装置
 ???????
??????? ??????
??????
A???????????? B????????? C
(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置 ???????????。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置 ????????????????。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置???????????。
(4)①某研究性小组查阅资料得知,漂白粉与硫酸溶液反应可制的氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4="2" CaSO4+2 Cl2+2H2O应选择装置?????????。
②为证明氯气具有氧化性将氯气分别通入到亚硫酸钠溶液和氯化亚铁溶液中,设计实验证明亚硫酸钠已经被氧化 ?????????????????????????????????????????????????????????????。
写出氯气和氯化亚铁溶液反应的离子方程式:???????????????????????????????????。
③请写出氯气尾气处理的离子方程式 ????????????????????????????????????????????。
参考答案:(1)A(2)C(3)A (4)① A ②取洗气瓶中C中的溶
本题解析:
试题分析:(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置是固体和液体之间不需要加热的,因此符合条件的是装置A。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置是固体和固体需要加热的,因此符合条件的是选项C。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置是固体和液体之间不需要加热的,因此符合条件的是装置A。
(4)①根据反应的方程式可知Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2+2H2O,该反应是固体和液体之间不需要加热制备气体的,所以应该选择装置A。
②由于亚硫酸钡不溶于水,但能溶于水酸中。而硫酸钡不溶于水,也不溶于酸,所以证明亚硫酸钠已经被氧化实验方法是取洗气瓶中C中的溶液少许,加入BaCl2溶液,再加入稀盐酸,若产生白色沉淀,则证明Na2SO3已被氧化;氯气和氯化亚铁溶液反应的离子方程式是Fe2++ Cl2=2 Fe3++2 Cl-。
③氯气有毒,需要尾气处理,一般用氢氧化钠溶液吸收,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+ 2H2O。
点评:本题主要是考查学生对于装置的选取方法的应用及方程式的书写等知识,可以很好的考查学生对于知识的理解和应用能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,有助于提升学生的学科素养,提高学生的应试能力和学习效率。
本题难度:一般
3、填空题 
 (9分)已知NH3与CuO在加热条件下可生成N2,方程式为2NH3+3CuO3Cu+N2+3H2O。纯氮气跟镁在高温下反应可得到氮化镁,氮化镁遇水反应可生成氢氧化镁和氨气。
(9分)已知NH3与CuO在加热条件下可生成N2,方程式为2NH3+3CuO3Cu+N2+3H2O。纯氮气跟镁在高温下反应可得到氮化镁,氮化镁遇水反应可生成氢氧化镁和氨气。


(1)下面是化学课外小组的同学提出的实验室制备氨气的几种方案:
A.硫酸铵固体与消石灰共热
B.浓氨水逐滴加到新制的生石灰中
C.在一定条件下,氮气与氢气化合
D.加热分解氯化铵固体
你认为其中较简单易行的方案有________________(填字母);其反应的化学方程式为:___________________________,___________________________。
(2)该小组同学设计的制备氮化镁的实验方案如下图 (夹持及加热仪器没有画出),且在实验前系统内的空气均已排尽。
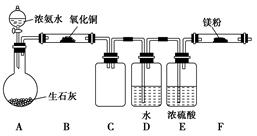
①该实验完成后,能否得到纯净的氮化镁________(填“能”或“不能”);简述理由____________________________________________________。
②装置C的作用是___________________________________.
参考答案:(1)AB (NH4)2SO4+Ca(OH)2CaSO4+2
本题解析:略
本题难度:一般
4、实验题 (2014届浙江省温州市十校联合体高三上学期期中联考化学试卷)
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L–1的Cu(NO3)2溶液、2.0mL 0.50 mol·L–1的NaOH溶液和0.25 mol·L–1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
表Ⅰ??????????????????????????????????????表Ⅱ