微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列叙述正确的是(??)
A.pH值等于5的HCl溶液和PH值等于9的NaOH溶液由水电离出的C(H+)之比为1:1
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.PH=2的HNO3溶液和PH=10的Ba(OH)2溶液等体积混合后的溶液的PH=7
D.向0.1 mol/L的氨水中加入少量醋酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
参考答案:A
本题解析:
试题分析:常温下,pH等于5的HCl溶液和pH值等于9的NaOH溶液由水电离出的C(H+)均为10-9mol/L,A正确;c(H+)=c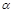 ,酸浓度越大,电离度越小。所以c1>10c2,B错误;pH=2的HNO3溶液和pH=10的Ba(OH)2溶液等体积混合后HNO3过量,pH<7,C错误;氨水
,酸浓度越大,电离度越小。所以c1>10c2,B错误;pH=2的HNO3溶液和pH=10的Ba(OH)2溶液等体积混合后HNO3过量,pH<7,C错误;氨水
本题难度:简单
2、选择题 下列各碱溶液,当其pH相同时,物质的量浓度最大的是
A.KOH
B.NH3·H2O
C.Ba(OH)2
D.NaOH
参考答案:B
本题解析:略
本题难度:一般
3、选择题 室温下pH、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A.加水稀释2倍后,两溶液的pH均减小
B.使温度都升高20℃后,两溶液的pH均不变
C.加等量的水稀释后,醋酸溶液的pH较盐酸小
D.加足量的锌充分反应后,醋酸产生的氢气比盐酸多
参考答案:CD
本题解析:
试题分析:醋酸是一元弱酸,存在电离平衡,稀释促进电离。盐酸是一元强酸,A不正确,加水稀释2倍后,两溶液的pH均增大;升高温度促进醋酸的电离,其水的离子积常数也是增大,B不正确;C正确,再pH相等的条件下,醋酸的浓度大于盐酸的,所以醋酸生成的氢气多,D正确,答案选CD。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:简单
4、选择题 能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是???????????????? ( )
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中加入NH4Cl固体 ⑤向水中加入NaHCO3固体 ⑥向水中加入NaHSO4固体
A.①②⑤
B.①④
C.③④⑥
D.④
参考答案:D
本题解析:①将水煮沸,仍呈中性,不符合题意;②向水中投入一小块金属钠反应后生成氢氧化钠,溶液呈碱性,故不符合题意;③向水中通入CO2气体抑制了水的电离,不符合题意;⑤向水中加入碳酸氢钠固体,碳酸氢钠水解促进水电离,水解后溶液呈碱性,则c(OH-)>c(H+),不符合题意;⑥向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,不符合题意。
本题难度:一般
5、选择题 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
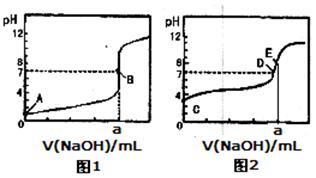
以HA表示酸,下列说法正确的是
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
参考答案:B
本题解析:
试题分析:因为滴定终点时NaCl溶液为中性,CH3COONa溶液为碱性,故滴定盐酸的曲线是图1,A错,相同的NaOH中和相同的酸C错;达到B、D状态时的pH=7,c(H+)=c(OH—),根据溶液的电荷守恒,c(Na+)=c(A—),B正确;在醋酸溶液中滴定NaOH,pH=7时,0mL< V(NaOH)<20.00mL,但有:c(A-)=c(Na+)>c(H+)=c(OH-),D不正确。
本题难度:一般