微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于Na2CO3和NaHCO3的比较,不正确的是
A.Na2CO3比NaHCO3稳定
B.常温下Na2CO3比NaHCO3易溶于水
C.Na2CO3和NaHCO3虽然都是盐,但它们的水溶液都显碱性
D.等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应得到的CO2物质的量比为2∶1
参考答案:D
本题解析:A项正确,Na2CO3的热稳定性比NaHCO3强;B项正确,常温下Na2CO3比NaHCO3易溶于水;C项正确;D项,得到的CO2物质的量比为1∶1.
本题难度:一般
2、选择题 硝酸亚铁Fe(NO3)2是一种受热易分解的盐,下列各组对硝酸亚铁受热分解产物的判断,可能符合事实的是
A.Fe2O3+N2O5
B.Fe2O3+NO2 +O2
C.FeO+NO2
D.Fe2O3+N2O 5 +O2[
参考答案:B
本题解析:
本题难度:困难
3、选择题 在冶金工业上,均不能用通常化学还原剂制得的金属组是
A.K、Na、Mg、Al
B.K、Na、Zn、Fe
C.Zn、Fe、Cu、Ag
D.Mg、Al、Zn、Fe
参考答案:A
本题解析:一些很活泼的金属,它们失电子的能力很强,通常的化学还原剂很难使其阳离子得到电子被还原成金属单质,其冶炼应用电解法.
本题难度:困难
4、选择题 用铝热法从下列氧化物中还原出物质的量相同的金属所消耗的铝最少的是
A.Fe3O4
B.MnO2
C.V2O5
D.Cr2O3
参考答案:A
本题解析:根据得失电子守恒,还原出1mol单质分别得电子为A、8/3mol;B、4mol;C、5mol;D、3mol;故消耗铝最少的为A。
本题难度:一般
5、选择题 称取两份铝粉,第一份加入足量的浓NaOH(aq),第二份加入足量的HCl(aq),如果放出的气体体积为1:3(在同温同压下),则两份铝粉的质量之比为
A.1:2
B.1:3
C.3:2
D.1:1
参考答案:B
本题解析:分析:因酸、碱足量,则铝完全反应,由电子守恒来计算Al的物质的量,铝的物质的量之比等于质量之比.
解答:放出的气体体积为1:3,设生成的氢气的物质的量分别为1mol、3mol,
设第一份中的Al的物质的量为x,第二份中的Al的物质的量为y,
因酸、碱足量,则铝完全反应,
由电子守恒可知,
x×3=1mol×2×(1-0),
y×3=3mol×2×(1-0),
解得x=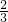 mol,y=2mol,
mol,y=2mol,
则两份铝粉的质量之比为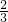 mol:2mol=1:3,
mol:2mol=1:3,
故选B.
点评:本题考查铝与酸、碱的反应,明确酸碱足量及反应均为氧化还原反应,利用电子守恒来计算是解答的关键.
本题难度:困难