微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1.92 g Cu投入到一定量的浓硝酸中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
A.504 ml
B.336 ml
C.224 ml
D.168 ml
参考答案:B
本题解析:
试题分析:1.92g?Cu的物质的量为n(Cu)=1.92g÷64g/mol=0.03mol,反应时失去电子数目为2×0.03mol=0.06mol,反应整个过程为HNO3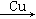 NO、NO2
NO、NO2 本题难度:一般
本题难度:一般
2、选择题 在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为(??? )
A.1/5 mol
B.2/5 mol
C.3/5mol
D.11/5 mol
参考答案:A
本题解析:
试题分析:根据方程式可知,硫酸铜中铜的化合价从+2价降低到+1价,得到1个电子。P元素的化合价从0价升高到+5价,失去5个电子,所以1mol硫酸铜能氧化单质P的物质的量是1/5 mol,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题,试题侧重考查学生分析问题,以及灵活解决问题的能力。该题的关键是明确P既是氧化剂,也是还原剂,因此解题的方法是根据电子的得失守恒进行,而不应该根据化学方程式中的系数。
本题难度:一般
3、简答题 硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下:

(1)将菱锌矿研磨成粉的目的是_______,滤液1后两步操作的目是:______.
(2)完成加漂粉精反应的离子方程式:
______Fe(OH)2+____________+____________→______Fe(OH)3+______Cl-
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是______.
(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据
______,______(用文字叙述)
(5)“滤液4”之后的操作依次为______、______、过滤,洗涤,干燥.
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于______.
参考答案:(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加
本题解析:
本题难度:一般
4、选择题 2011年4月10日,我国在西昌卫星发射中心用“长征三号甲”运载火箭,成功将第八颗北斗导航卫星送入太空预定转移轨道。该火箭所用燃料是偏二甲肼(CH3-NH-NH-CH3)和四氧化二氮(N2O4)。在火箭升空过程中,燃料发生反应:CH3-NH-NH-CH3+2N2O4→2CO2+3N2+4H2O,提供能量。下列有关叙述正确的是(?)

A.该反应中N2O4是氧化剂,偏二甲肼是还原剂
B.N2是氧化产物,CO2是还原产物
C.CO2是氧化产物,N2是还原产物
D.每有0.6molN2生成,转移电子数目为2.4NA
参考答案:A
本题解析:偏二甲肼(CH3-NH-NH-CH3)中C为-2价,N也是-2价,四氧化二氮(N2O4)中N是+4价,二氧化碳中C是+4价,根据化合价的变化,可判断出,偏二甲肼被氧化为氮气和二氧化碳,四氧化二氮被还原为氮气。所以偏二甲肼是还原剂,N2O4是氧化剂。氮气既是氧化产物也是还原产物,二氧化碳是氧化产物。所以B,C不对。反应中2molN2O4得16mol电子,生成3molN2,所以生成0.6molN2,转移电子数目为3.2NA
本题难度:一般
5、填空题 (12分)氧化还原是一类重要的反应。
(1)已知反应:①Cu+2Fe3+=Cu2++2Fe2+,②Cu2++Fe=Cu+Fe2+
反应①中还原剂是?????,两个反应中各种离子的 氧化性从强到弱的顺序是???????。
氧化性从强到弱的顺序是???????。
(2)在反应MnO2+4HCI MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是?????????????????。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是?????????????????。
(3)已知反应:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
①铜与稀硝酸反应的离子方程式是??????????????。
②下列物质中,放到铜粉和稀硫酸中,能实现铜粉溶解的是?????????。
A. KNO3??? B. K2SO4??? C. Cu(NO3)2
③a g铜粉与足量的某浓度HNO3溶液完全反应后,产生V L(标准状况)气体,反应中消耗的HNO3的物质的量是???????????????。
参考答案:(1)还原剂是 Cu ?,顺序是Fe3+
本题解析:略
本题难度:一般