微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将所得溶液用石墨做电极进行电解,阳极生成的物质是:
A.H2
B.Ag
C.Cl2
D.O2
参考答案:D
本题解析:略
本题难度:简单
2、选择题 能正确表示下列反应的离子方程式是
A.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+ 6H+ = 2Mn2+ + 5NO3-+ 3H2O
B.碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3-+2OH- = CO32-+ NH3?H2O +H2O
C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I- = 2Fe 2+ + I2
D.用惰性电极电解熔融氯化钠:2Cl-+2H2O = Cl2↑+H2↑+2OH-
参考答案:A
本题解析:
试题分析:A、MnO4?在酸性条件下把NO2-氧化为NO3?,离子方程式为:2MnO4-+5NO2-+ 6H+ = 2Mn2+ + 5NO3-+ 3H2O,故A正确;B、碳酸氢铵溶液中加入足量氢氧化钡溶液,生成BaCO3沉淀,故B错误;C、Fe(NO3)3溶液中加入过量的HI溶液,发生的反应为NO3?、H+氧化I?,故C错误;D、用惰性电极电解熔融氯化钠,离子方程式为:2Cl?+2Na+ Cl2↑+2Na,故D错误。
Cl2↑+2Na,故D错误。
考点:本题考查离子方程式。
本题难度:一般
3、选择题 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
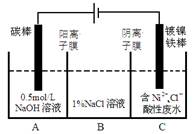
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH— -4e—=O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
参考答案:B
本题解析:
试题分析:由图知,碳棒与电源正极相连是电解池的阳极,电极反应4OH- -4e-=2H2O+O2↑,镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e- = Ni。电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大。又因Ni2+在弱酸性溶液中易发生水解;氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH 。若将图中阳离子膜去掉,由于放电顺序Cl->
本题难度:一般
4、选择题 按规定在食盐中添加一定量的碘化钾(KIO3)即成为可以为人体补充碘元素的“加碘食盐”。KIO3可用在一定温度下电解KI水溶液的方法制得。以下关于这一生产得叙述正确的是(?????)
A.KIO3在阳极产生,阴极产物为H2
B.可以用不锈钢棒作两个电极的材料
C.产生IO3-离子的电极周围溶液pH增大
D.溶液中阳离子向阳极移动
参考答案:A
本题解析:A、电解KI水溶液时,阳极反应为:I--6e-+6OH-=I03-+3H2O,阴极反应为:2H+-2e-=H2↑,故 A正确;
B、电解时应用惰性电极做电极材料,否则在阳极上放电的不是I-离子,导致电解得不到所需物质,故B错误;
C、根据阳极反应:I--6e-+6OH-=I03-+3H2O,可知阳极反应消耗OH-离子,阳极区的PH减小,故C错误;
D、电解池工作时,阴离子向阳极移动,阳离子向阴极移动,故D错误.
故选A
本题难度:一般
5、选择题 工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下:

下列说法正确的是???????????????????? ( )。
A.酸溶时,MnO2作还原剂
B.可用盐酸代替硫酸进行酸溶
C.原料硫酸可以循环使用
D.在电解池的阴极处产生MnO2
参考答案:C
本题解析:A项,酸溶时反应为MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O,根据化合价的升降MnO2为氧化剂,错误;B项,假如换成用盐酸来酸溶,阳极发生的反应就是:2Cl--2e-=Cl2↑,得不到MnO2,错误;C项,根据流程图可知硫酸可循环利用,正确;D项,电解时阳极Mn2+-2e-+2H2O=MnO2+4H+,错误。
本题难度:一般