微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
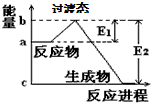
1、填空题 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是非通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和
CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是____________(填“吸热”或“放热”)反应,NO2和CO的总能量_________(填“>”、“<”或“=”)CO2和NO的总能量。
(2)在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应:
NO2+CO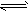 CO2+NO,2min时,测得容器中NO的物质的量为0.5mol ,则:
CO2+NO,2min时,测得容器中NO的物质的量为0.5mol ,则:
①该段时间内,用CO2表示的平均反应速率为____________
②2min时,容器内气体的总物质的量为______________
③假设此反应在5min时达到平衡,则此时容器内气体的总物质的量__________(填“大于”、“小于”或“等于”)2min时容器内气体的总物质的量。
2、选择题 (10分)(1)已知可逆反应:M(g)+N(g) P(g)+Q(g)?ΔH>0,
P(g)+Q(g)?ΔH>0,
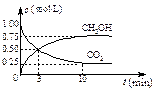
若要增大Q的浓度,在其它条件不变的情况下可以采取的措施为????(填序号)。
A.加入一定量M???? B.降低反应温度???? C.升高反应温度????
D.缩小容器体积???? E.加入催化剂?????? F.分离出一定量P
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)???????△H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)???△H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)??????△H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________???????????????????????????????????????????????????????????。
(3)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g)? ΔH=-49.0 kJ/mol, 测
CH3OH(g)+H2O(g)? ΔH=-49.0 kJ/mol, 测
得CO2和CH3OH(g)的浓度随时间变化如右图所示。
①从3 min到10 min,v(H2)=?????mol/(L·min)。
②能说明上述反应达到平衡状态的是?????????(选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是????????(选填编号)。
A.升高温度????????????????????? B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离????????? D.恒温恒容再充入1 mol CO2和3 mol H2
3、选择题 下面关于化学反应的限度的叙述中,不正确的是
A.任何可逆反应都有一定的限度
B.化学反应达到限度时,正逆反应速率相等
C.化学反应的限度可以通过改变条件而改变
D.当一个化学反应在一定条件下达到限度时,反应即停止
4、填空题 (12分)(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1?????T2(填“>”、“<”或“=”);A、C两点的速率vA ??????vC(
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1?????T2(填“>”、“<”或“=”);A、C两点的速率vA ??????vC( 同上)。
同上)。

(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
|
n(NO2)/mol
| 0.40
| n1
| 0.26
| n3
| n4
|
n(N2O4)/mol
| 0.00
| 0.05
| n2
| 0.08
| 0.08
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为??????????????;
②该反应的平衡常数K的值为???????????????;
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是????mol/L。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为???????????;(结果保留小数点后一位)
5、选择题 在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是(??)
A.在2 s时,体系内压强为反应前的1.1倍
B.前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
C.平衡时,体系内含N2O4 0.25 mol
D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率
|