微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、H3AsO4、H2O和一种未知物质X.
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 .
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为: .
(3)依据(2)的X写出该反应的完整的化学方程式:
(4)根据上述反应可推知
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:ASH3>X d.还原性:X>ASH3
参考答案:(1)AsH3 (2)Br2
(3)8KB
本题解析:
试题分析:(1)KBrO3在反应中得到电子,所以KBrO3是氧化剂,AsH3变成了H3AsO4,砷元素化合价升高,所以还原剂是AsH3
(2)设X中溴元素的化合价为x,根据电子守恒可得:0.2mol(5-x)=1mol,所以x=0,故X为Br2。
(3)化合价升高的元素是砷元素,化合价从-3价升到+5价,化合价降低的元素是溴元素,化合价从+5价降到0价,根据化合价升高和降低数目得相等配平化学方程式可得:8KBrO3+5AsH3+4H2SO4=4K2SO4+5H3AsO4+4H2O+4Br2
(4)在反应中,氧化剂为KBrO3,还原剂为AsH3,氧化产物为H3AsO4,还原产物为Br2,
由氧化剂的氧化性大于氧化产物的氧化性可知KBrO3>H3AsO4,由还原剂的还原性大于还原产物的还原性可知AsH3>X (Br2),故答案为:ac。
考点:本题考查氧化还原反应原理及配平。
本题难度:一般
2、选择题 某种金属因其密度小、延展性好、耐腐蚀性强,它和它的合金材料在航空、航海和化学工业中正逐步取代铝和铝合金材料而被广泛利用,该金属是
A.铁
B.锌
C.钛
D.镍
参考答案:C
本题解析:
正确答案:C
铁锌镍都是重属元素,其中镍是银白色金属,密度8.9克/cm3。熔点1455℃,沸点2730℃。
本题难度:简单
3、计算题 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生的反应:
C(s)+O2(g)=CO2(g)??????????????ΔH1=-393.5kJ/mol?????????①
C(s)+ CO2(g)  2CO(g)???????ΔH2="+172.5" kJ/mol??????②
2CO(g)???????ΔH2="+172.5" kJ/mol??????②
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s)???ΔH3="-13.7" kJ/mol??????????③
请回答下列问题:
(1)??计算3 Fe(s)+2 O2(g)= Fe3O4(s)的ΔH=__________________________。
(2)??800℃时,C(s)+ CO2(g)  2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
(3)??某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol/L的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+??? 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
计算:①该铁矿石中铁元素的质量分数。
②计算氧化物FemOn的化学式( m、n为正整数)。
参考答案:⑴-1118.3 kJ/mol?????????⑵正???(
本题解析:
试题分析:(1)根据盖斯定律可知,(①-②)×2-③即得到3 Fe(s)+2 O2(g)=Fe3O4(s),所以该反应的ΔH=(-393.5kJ/mol-172.5 kJ/mol)×2+13.7 kJ/mol=-1118.3 kJ/mol?。
(2)当c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时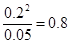
本题难度:困难
4、填空题 (2分)配平方程式: Zn + HNO3— Zn(NO3)2 + N2 + H2O
参考答案: 本题解析:略
本题解析:略
本题难度:一般
5、选择题 将4.9克Mg和Fe的混合物在一定量的稀HNO3溶液中完全溶解(溶液中有Fe2+),得到标况下气体2.24L(假设全为NO气体),则向反应后的溶液中加入足量的烧碱,在空气中不断搅拌,充分反应后,则生成沉淀的质量是? (???? )
A.6g
B.8g
C.10g
D.10.2g
参考答案:D
本题解析:最后沉淀质量=OH-质量+金属质量。由题意可知,金属虽说全溶解,但铁还没有全被氧化成三价铁,加足量的NaOH在空气中不断搅拌,Fe(OH)2将全部被氧化,所以生成的沉淀一定为Mg(OH)2、Fe(OH)3 ,不可能有Fe(OH)2 .在此还要注意的是,整个过程中既有硝酸得电子又有氧气得电子。硝酸得的电子有关系式NO3?~NO~3e-为0.3mol,如再加上空气中氧气得的电子,那么整个过程中得电子数肯定大于0.3 mol,为此金属失去的电子数也大于0.3mol.由于金属阳离子电荷总数等于金属离子结合的OH-
本题难度:一般