微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式???????????????????????,第二步的电离平衡常数表达式Ka2=??????????????。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是????????????。
①I-????????????②Fe3+?????????????③Cu2+???????????④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式:??????????????????。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:
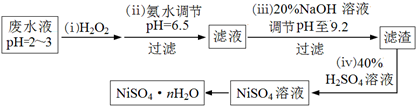
①第(ⅰ)步,加入H2O2反应的离子方程式??????????????????。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是????????????????。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为??????????????。
参考答案:(1)H2O2 本题解析:
本题解析:
试题分析:(1)第一步电离,1个H2O2电离出1个H+,电离方程式为:H2O2 H+ + HO2-;第二步电离为:HO2-
H+ + HO2-;第二步电离为:HO2- 本题难度:一般
本题难度:一般
2、计算题 已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,常温下能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。
现将a mol PbO2加热分解,收集产生的O2;加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。两步反应中收集来源:91考试网 91Exam.org的O2和Cl2的物质的量之和为y mol。
(1)若Fe3O4可表示为FeO·Fe2O3,则Pb2O3可表示为?????????????????????????????
(2)试写出Pb2O3与浓盐酸反应的化学方程式????????????????????????????????????
(3)通过计算确定y与a、x的函数关系式____________________________。
参考答案:(1)PbO .Pb2O3
(2)Pb2O3+6HCl
本题解析:略
本题难度:简单
3、填空题 (9分)在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,?????是氧化剂;???????????????是氧化产物;
参考答案:HNO3、 Cu(NO3)2
本题解析:
试题分析:氧化剂得电子,化合价降低,所以是硝酸;氧化产物是还原剂化合价升高后的生成物,所以是硝酸铜。
点评:氧化剂、氧化产物概念的直接应用,属于简单题。
本题难度:一般
4、简答题 用Na2SO3可以治理工业SO2尾气污染,这是一种治理SO2污染比较新颖的方法.具体操作:①将含有SO2气体的尾气通入到Na2SO3溶液中,发生化合反应生成NaHSO3;②将反应后的溶液加热,即可逸出SO2气体,这些SO2可以应用于制取H2SO4.该方法中Na2SO3可以循环使用,符合绿色化学的基本原则.请根据上述信息解答下列试题:
(1)写出①、②两步的化学方程式:①______;②______.
(2)当89.6m3(标准状况)含有SO2的尾气通入溶液中时,恰好与10m3的0.1mol/L的Na2SO3溶液发生反应.求该尾气中SO2气体的体积分数.
参考答案:(1)Na2SO3能与SO2反应生成酸式盐NaHSO3,反应
本题解析:
本题难度:一般
5、选择题 关于反应Cl2 + H2O =" HCl" + HClO,下面是四位同学对该反应和所涉及的知识发表部分见解,其中不正确的是
A.该反应属于氧化还原反应
B.水是还原剂
C.该反应是离子反应
D.两种产物均为电解质
参考答案:B
本题解析:该反应是氯元素的自身氧化还原反应,氯元素由0价升至+1价、降至—1价,水并没有参加氧化还原反应;
该反应属于离子反应,产物均为酸,属于电解质:Cl2+H2O=H++Cl-+HClO
本题难度:一般