微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验的前后,铜的质量一定发生变化的是
A.铜丝在空气中灼烧后立即插入乙醇
B.铜片放入酸化的硝酸钠溶液
C.铜和铁的混合物放入稀硝酸
D.铜、锌、稀硫酸构成的原电池放电
参考答案:B
本题解析:分析:A、铜灼烧生成了氧化铜,氧化铜和乙醇反应生成了乙醛和铜;
B、铜和稀硝酸反应生成了硝酸铜;
C、铁的还原性大于铜的还原性,铁先反应;
D、锌在原电池中作负极,被氧化,铜质量不变.
解答:A、由于氧化铜能够和乙醇反应生成乙醛和铜,铜变成氧化铜,氧化铜又被还原成铜,最终铜质量没有变化,故A错误;
B、铜和稀硝酸反应生成了硝酸铜,质量一定减少,故B正确;
C、由于铁还原性大于铜的,铁先参加反应,若是铁足量,铜变化消耗,故C错误;
D、铜、锌构成的原电池,锌是负极,铜是正极不消耗,故D错误;
故选B.
点评:本题考查了铜的化学性质,涉及了原电池的知识,联系所学知识能够完成,本题难度中等,
本题难度:困难
2、选择题 KCl、KBr的混合物3.87g溶于水中,加入过量的AgNO3溶液,充分反应后,得到沉淀6.63g,则原混合物中钾元素的质量分数为
A.0.241
B.0.259
C.0.403
D.0.487
参考答案:C
本题解析:分析:发生反应KCl、KBr转化为AgCl、AgBr,由于银离子代替钾离子导致质量增大,由电荷守恒可知n(K+)=n(Ag+),结合质量差计算n(K+),再根据m=nM计算m(K+),再根据质量分数的定义计算.
解答:发生反应KCl、KBr转化为AgCl、AgBr,由于银离子代替钾离子导致质量增大,由电荷守恒可知n(K+)=n(Ag+),则108g/mol×n(K+)-39g/mol×n(K+)=6.63g-3.87g,解得n(K+)=0.04mol,
故原混合物中钾元素的质量分数=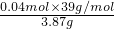 ×100%=40.3%,
×100%=40.3%,
故选C.
点评:本题考查混合物的有关计算,难度中等,注意根据反应分析质量变化的原因,注意电荷守恒利用判断n(K+)=n(Ag+)是解题的关键,比较过程法更简单.
本题难度:简单
3、选择题 在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是?????????????????????????? ( )
A.最后得到的溶液中含有Fe3+
B.残余固体可能为铁、铜混合物
C.最后得到的溶液中只含Cu2+
D.残余固体一定全部是铜
参考答案:B
本题解析:试题分析:本题涉及的反应有:(1)Cu+2Fe3+==Cu2++2Fe2+,(2)Fe+Cu2+==Fe2++Cu,所以C不正确;由于题目中b<c,说明所加的Fe的量不确定,若Fe的量不足,说明Cu没有被全部置换出来,Cu2+ 没有完全反应掉,故残留固体全部为Cu;若Fe过量,且符合b<c,则残余固体可能为铁、铜混合物,所以B正确,D不正确;因为Fe3+能够氧化Cu,所以当残留固体中有Cu存在时,溶液中一定不含有Fe3+,所以A不正确。故选B。
考点:铁及其化合物的知识
点评:本题主要考查铁及其化合物的知识,要求会判断反应物与产物,题目难度中等。
本题难度:一般
4、选择题 下列反应能以离子方程式OH-+H+=H2O表示的是
A.氢氧化钾和醋酸
B.氢氧化镁和盐酸
C.氢氧化钡和稀硫酸
D.氢氧化钠和稀硫酸
参考答案:D
本题解析:分析:稀的强酸与稀的强碱反应生成可溶性盐和水的反应,可用离子反应OH-+H+=H2O表示.
解答:A、氢氧化钾和醋酸的离子反应为OH-+HAc=H2O+Ac-,故A不选;
B、氢氧化镁和盐酸反应的离子反应为Mg(OH)2+2H+=2H2O+Mg2+,故B不选;
C、氢氧化钡和稀硫酸反应的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C不选;
D、氢氧化钠和稀硫酸反应的离子反应为OH-+H+=H2O,故D选;
故选D.
点评:本题考查离子方程式的书写,明确常见的物质的溶解性、弱电解质在离子反应中应保留化学式是解答本题的关键,难度不大.
本题难度:简单
5、选择题 等体积的AlCl3溶液和NaOH溶液混合后,若沉淀中含Al的质量与溶液中含Al的质量相等,则AlCl3溶液和NaOH溶液的物质的量浓度之比为
A.3∶2
B.2∶4
C.1∶4
D.2∶7
参考答案:D
本题解析:
本题难度:一般