微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。

请回答下列问题。
(1)?图中涉及分离溶液与沉淀的方法是____________________________。
(2)? B、C、D、E四种物质的化学式为:
B__________、C__________、D__________、E__________。
(3) 写出下列反应的离子方程式:
沉淀F与NaOH溶液反应________________________________。
沉淀E与稀硫酸反应____________________________。
溶液G与过量稀氨水反应________________________________。
参考答案:(1) 过滤??(2) B:? Al2O3?? C:? Fe
本题解析:
试题分析:Al2(SO4)3、Al2O3和Fe2O3中Al2(SO4)3溶于水,Al2O3溶于NaOH,可确定B:? Al2O3?? C:? Fe2O3?? D:? NaAlO2?? E: Al(OH)3。
本题难度:一般
2、填空题 (8分) 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题:
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式:_______________________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是______________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式:______________________________。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
3、填空题 某研究小组将一批废弃的线路板经浓硝酸和稀硫酸处理后得到一混合溶液,其中含有Cu2+、Fe2+、Fe3+、Al3+等金属离子,并设计了以下两种流程以分别制取CuSO4·5H2O晶体和AlCl3
溶液:
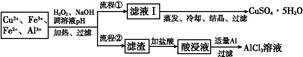
已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
离子
| Fe3+
| Fe2+
| Al3+
| Cu2+
|
pH范围
| 2.2~3.2
| 5.5~9.0
| 4.1~5.0
| 5.3~6.6
请回答下列问题:
(1)加入H2O2的作用是 ??????????????????????????????????,欲使制取的CuSO4·5H2O晶体较为纯净,pH至少应调至 。
(2)写出H2O2与Fe2+反应的离子方程式:??????????????????????????????????????。
(3)流程②中加入适量Al粉起的作用是?????????????????????? 。
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3 (填“能”或“不能”),原因是 ????????。
(5)取体积为V(L)的酸浸液,向其中滴加a mol·L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图。请用V1、V2、V3表示所取的酸浸液中n(Fe3+)∶n(Al3+)= ???????????????????。

参考答案:(1)将Fe2+氧化为Fe3+ 5.0
(2)2Fe2
本题解析:(1)由相关金属离子沉淀,pH范围图表可知:Fe2+与Cu2+沉淀pH范围存在交叉,不易除去,故加入H2O2将Fe2+氧化为Fe3+,可避免这一问题,并且调节pH为5.0,可以将Al3+与Fe3+同时除去。
(2)H2O2与Fe2+反应的离子方程式为:H2O2+2Fe2++2H+ 2Fe3++2H2O。 2Fe3++2H2O。
本题难度:困难
4、实验题 镁在高温下与O2、N2或CO2均可以发生反应,试解决下列问题。
(1)工业通常采用电解熔融氯化镁冶炼金属镁,不以氧化镁为原料的理由是???????。
(2)将燃着的镁条伸入盛满CO2的集气瓶中,镁条剧烈燃烧,发出耀眼的白光,瓶内壁上有黑色物质生成,化学方程式为?????????????????????????????????。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的反应步骤为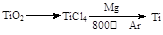
金属镁的作用为?????????????,在Ar气氛中的进行的理由是??????????????。
(4)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知:
Mg+H2O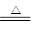 MgO+H2↑?????Mg3N2 +6H2O =3Mg(OH)2+2NH3↑ MgO+H2↑?????Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示。
 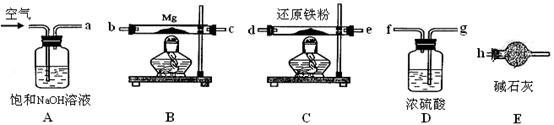
①导管口间的连接次序是:a →( )()→()()→()()→ h
②通气后,应先点燃??????????(填“B”或“C”)装置的酒精灯,装置A的作用是???????????,装置E的作用是????????????。
③请设计一个简单的小实验验证产物是氮化镁???????????????????????????????。
参考答案:(1)MgO熔点很高,能耗太大
(2)2Mg+CO2
本题解析:
试题分析:(1)工业通常采用电解熔融氯化镁冶炼金属镁,不以氧化镁为原料的理由是MgO熔点很高,能耗太大。(2)将燃着的镁条伸入盛满CO2的集气瓶中,镁条剧烈燃烧,发出耀眼的白光,瓶内壁上有黑色物质生成,化学方程式为2Mg+CO2 2MgO+C。(3)?金属镁的作用为作还原剂。在Ar气氛中的进行的理由是氩气 2MgO+C。(3)?金属镁的作用为作还原剂。在Ar气氛中的进行的理由是氩气
本题难度:一般
5、选择题 下列陈述I、II正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II
A
浓H2SO4有吸水性
浓H2SO4可用于干燥氨气
B
SO2有氧化性
SO2尾气可用NaOH溶液吸收
C
Mg有还原性
电解MgCl2饱和溶液可制备Mg
D
锌金属活动性比铁强
海轮外壳上装锌块可减缓腐蚀
A.A
B.B
C.C
D.D
参考答案:D
本题解析:
本题难度:简单
|
|