微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在含0.3mol AlCl3的氯化铝溶液中加入200 mL烧碱溶液,能生成0.1mol沉淀,则加入烧碱溶液物质的量浓度可能是:①1.5 mol·L-1?②4.5 mol·L-1?③5.5 mol·L-1?????( )
A.②
B.①
C.③
D.①、③
参考答案:D
本题解析:
试题分析:通过发生的化学反应进行计算
假设烧碱少量,发生的化学反应只有Al3++3OH-═Al(OH)3↓,生成0.1mol沉淀,烧碱的物质的量为0.3mol,浓度为1.5 mol·L-1。
假设烧碱过量,发生的化学反应有Al3++3OH-═Al(OH)3↓和Al(OH)3+OH-═AlO2-+2H2O,生成0.1mol沉淀,烧碱的物质的量为0.3mol为1.1mol,浓度为5.5 mol·L-1。
故选D。
点评:本题考查铝离子与碱的反应,明确碱的物质的量对发生的化学反应
本题难度:一般
2、选择题 相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是[???? ]
A.Al
B.Al(OH)3
C.AlCl3
D.Al2O3
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列实验现象、操作或反应原理的解释正确的是( )
| 现象、操作或反应 | 解释
A铝箔在酒精灯火焰上加热熔化不滴落
铝箔对熔化的铝有吸附作用
B向滴有稀硫酸的热淀粉液中滴加碘水,
?? 液体呈蓝色
此条件下淀粉没有完全水解
C向pH试纸上滴加氯水,先变红后褪色
氯水显酸性
D鸡蛋清溶液遇乙酸铅溶液会产生沉淀
蛋白质发生盐析
A.A
B.B
C.C
D.D
参考答案:B
本题解析:
本题难度:简单
4、选择题 实验室中,要使偏铝酸钠溶液中的AlO2-离子全部沉淀出来,最适宜用的试剂是
A.NaOH溶液
B.CO2
C.盐酸
D.氨水
参考答案:B
本题解析:
试题分析:要使偏铝酸钠溶液中的AlO2-离子全部沉淀出来,则需要加入酸将其转化为氢氧化铝沉淀。但由于氢氧化铝是两性氢氧化物,能溶于酸或强碱溶液中,所以应该选择弱酸,例如碳酸等。A、氢氧化钠溶液显碱性,与AlO2-离子不反应,A不正确;B、CO2通入到含有AlO2-离子的溶液中生成氢氧化铝沉淀而析出,B正确;C、盐酸虽然能和AlO2-离子反应生成氢氧化铝,但过量的盐酸能溶解氢氧化铝,C不正确;D、氨水显碱性,与AlO2-离子不反应,D不正确,答案选B。
本题难度:一般
5、选择题 在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是(??)
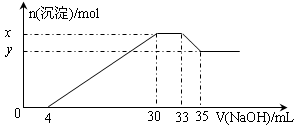
A.原溶液中n(Mg2+)∶n(Al3+)=10∶1
B.原溶液的c(H+)=0.8 mol/L
C.x与y的差值为0.01 mol
D.原溶液中c(Cl-)=0.66mol/L
参考答案:D
本题解析:
试题分析:由图象可知,开始加入氢氧化钠没有沉淀生成,0~4mL发生反应H++OH-=H2O,4mL时H +反应完毕,4~30mL发生反应Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,30mL时沉淀量最大,Mg2+、Al3+沉淀完全,30~33mL沉淀量不变,发生NH4+与氢氧化钠的反应NH4++OH-=NH3·H2O,33~35mL发生Al(OH)3与氢氧化钠的反应Al(OH)3+OH-=AlO2-+2H2O,0~4mL发生H+与氢氧化钠的反应,则H+的物质的量为4m
本题难度:一般
|