微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、判断题 标明下列装置中电解池的阴极和阳极,试写出电极反应式,并判断是氧化反应还是还原反应。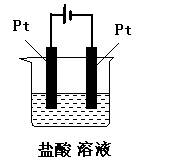
参考答案:与电源正极相连的一极是电解池的阳极,反应式为:2Cl-→Cl
本题解析:在电解池中,与电源正极相连、发生的电极反应
是氧化反应的电极是阳极,与电源负极相连、发生的电极
反应是还原反应的电极是阴极。依据这个原则即可标明电
解池的阴极和阳极,试写出电极反应式,并判断是氧化反
应还是还原反应。
本题难度:一般
2、选择题 下列处理方法正确的是
A.为除去污水中的重金属离子Hg2+,向其中加入足量充分反应后过滤
B.为降低能耗,工业电解熔融态的Al2O3制Al时,加入冰晶石
C.为充分利用原料,氯碱工业中,将阳极室的饱和氯化钠溶液电解为水后导出
D.为保护公路两旁的铁护栏,将其与电源的负极相连
参考答案:B
本题解析:
试题分析:A项:加入Pb粉虽能置换出Hg,但Pb2+会留在溶液中,故错。C项:应该为:电解后的淡盐水从阳极导出,可重新用于配制食盐水,故错。D项:铁护栏连上电会很危险,故错。故选B。
点评:本题重点考查的是电解原理的相关知识,学生要弄清楚电解原理才能正确的解答出本题。电解是将电流通过电解质溶液或熔融态物质,(又称电解液),在阴极和阳极上引起氧化还原反应的过程,电化学电池在外加电压时可发生电解过程。电流流进负电极(阴极),溶液中带正电荷的正离子迁移到阴极,并与电子结合,变成中性的元素或分子;带
本题难度:简单
3、选择题 按图装置进行电解(均是惰性电极),已知A烧杯中装有500 mL20%的NaOH溶液,B烧杯中装有500 mL pH为6的1 mol·L-1CuSO4溶液。通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)
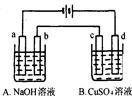 ??
??
A.4
B.3
C.2
D.1
参考答案:C
本题解析:
试题分析:根据装置图可知,a电极和电源的负极相连,作阴极,则b电极是阳极,溶液中的OH-放电,电极反应式是4OH--4e-=2H2O+O2↑。氧气的物质的量是0.028L÷22.4L/mol=0.00125mol,转移电子的物质的量是0.00125mol×4=0.005mol。B中总的方程式是2CuSO4+2H2O 本题难度:一般
本题难度:一般
4、选择题 用石墨作电极电解CuCl2溶液,当通电一段时间后,收集到2.24L气体(标准状况).下列有关说法正确的是( )
A.阳极生成的铜
B.上述电解过程中共转移0.2?mol电子
C.电解得到的Cu的物质的量为0.5mol
D.电解后溶液呈碱性
参考答案:A.阳极反应为2Cl--2e-=Cl2↑,阴极反应为Cu2+
本题解析:
本题难度:简单
5、填空题 现在工业上主要采用离子交换膜法电解饱和食盐水制取NaOH、H2和Cl 2。请回答下列问题:
⑴在电解过程中,与电源正极相连的电极上所发生的电极反应式为?????????????????。
⑵电解之前,食盐水需要精制,目的是除去粗盐中的、Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为(填试剂序号)?????????????????????????????。
⑶如果在容积为10L的离子交换膜电解槽中,1min后在阴极可产生11.2L(标准状况)Cl2,这时溶液的pH值是??????(填“升高”、“降低”或“不变”),溶液中c(OH-)为(设体积保持不变)???????????????。
⑷若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是?????????????????
????????????????????????????????????????????????????????????。
参考答案:⑴2Cl-→ Cl2↑+2e-;⑵b、a、c;⑶升高,0.1
本题解析:此题是在考查电解食盐水的基础之上,同时考查粗盐的精制。解题时,要紧扣电解原理,电子守恒分析。⑴与电源正极相连的是阳极,阴离子Cl-放电,电极反应式为:2Cl-→ Cl2↑+2e-。⑵加入Ba(OH)2后过量的Ba2+应该用Na2CO3溶液除去,最后加入盐酸除去,并调节溶液的酸碱性(加盐酸之前,必须过滤,否则沉淀又溶解了)。⑶电解饱和食盐水过程中产生了NaOH,使溶液的碱性增强,pH值升高;依据总方程式:2NaCl+2H2O 本题难度:一般
本题难度:一般