微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4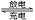 2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
闭合S,发现G电极附近的溶液变红,20 min后,将S断开,此时C、D两极上产生的气体体积相同;据此回答:
(1)A电极的电极材料是______________(填“PbO2”或“Pb”)。
(2)电解后,要使丙中溶液恢复到原来的浓度,需加入的物质是________(填化学式)。
(3)到20 min时,电路中通过电子的物质的量为________。
(4)0~20 min,H电极上发生反应的电极反应式为______________
2、选择题 如下图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是

A.电源的M 极为正极
B.甲装置中溶液的pH 减小
C.甲装置的两个电极上都有单质生成且物质的量之比为1︰1
D.欲用乙装置给铜镀银,U 极应该是Ag,电镀液选择AgNO3溶液
3、填空题 某学生设计了如图4-8所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4 H2↑+CuSO4,试回答:
H2↑+CuSO4,试回答:
(1)该装置的名称是???????(填“电解池”或“原电池”)。
(2)A、B中至少有一种是金属???????,接?????????。
(3)C溶液中含有????????。
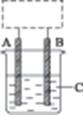
图4-8
4、填空题 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法该法的工艺流程为:
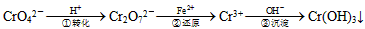
其中第①步存在平衡:2CrO42-(黄色)+2H+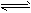 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
⑴若平衡体系的pH=2,该溶液显________色。
⑵能说明第①步反应达平衡状态的是________。
a. Cr2O72-和CrO42-的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c. 溶液的颜色不变
⑶第②步中,还原1molCr2O72-离子,需要________mol的FeSO4·7H2O。
⑷第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)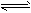 Cr3+(aq)+3OH-(aq) 常温下,
Cr3+(aq)+3OH-(aq) 常温下,
Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
⑸用Fe做电极的原因为___________________。
⑹在阴极附近溶液pH升高的原因是(用电极反应解释)__________________________,溶液中同时生成的沉淀还有______________。
5、选择题 下列各组中,每种电解质溶液在惰性电极条件下电解时只生成氢气和氧气的是( )
A.HCl、CuCl2、Ba(OH)2
B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2
D.NaBr、H2SO4、Ba(OH)2