微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上用重晶石(主要成分BaSO4)为原料制备BaCl2和锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用来源:www.91exam.org下述工艺流程
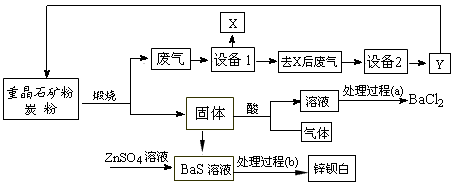
请根据上述流程回答下列问题
(1)假设煅烧时还原产物只有BaS,则反应的化学方程式为___________________________;
(2)设备2中所用的洗涤剂是碱液,则Y的化学式为________________________;
(3)溶解固体所用的酸为____________(写化学式),生成的气体用过量NaOH溶液吸收,其反应的离子方程式为_______________________________;
(4)处理过程(b)的具体步骤为______________________;
(5)锌钡白的成分是___________________(写化学式)。
2、填空题 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂的部分工艺流程如下

已知:
①Li2O·Al2O3·4SiO2+H2SO4(浓) Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示。

(1)从滤渣1中分离出Al2O3的一种方法为:在滤渣中加入适量盐酸,过滤后在滤液中加入足量溶液X,再过滤,对沉淀进行干燥,灼烧。则溶液X为______________。
(2)滤渣2的两种主要成分为:____________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水”而不用冷水洗涤的原因是____________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电 极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是____________。
②b中,生成Li2CO3反应的化学方程式是____________。
3、填空题 硫酸铜在工农业生产中有着广泛的应用,用某种氧化铜矿制备硫酸铜的工艺流程如下
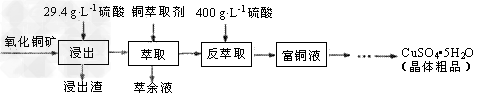
(1)浸出时所用硫酸的质量浓度(单位体积的溶液所含溶质的质量)为29.4g·L-1,其物质的量浓度是_____,浸出过程中反应的化学方程式是___________________。
(2)萃取“相比”是表示萃取效果的参数之一,指的是有机相(O)与水相(A)的体积比。采用一定浓度的铜萃取剂萃取硫酸浸出液中的铜离子,测得当萃取时间为120s时, “相比”(O/A)对铜萃取率的影响如图所示。在实际操作中“相比”应选择_______?。(填序号)
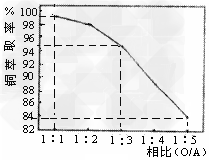
A.1:1???B.1:3???C.1:5
(3)已知铜萃取剂可用HR(O)表示,萃取过程可表示为:Cu2++2HR(O) CuR2(O)+2H+,反萃?取加入400?g/L??硫酸的理由是________________。
CuR2(O)+2H+,反萃?取加入400?g/L??硫酸的理由是________________。
(4)从富铜液中获得较多晶体粗品的实验操作依次是________、________(填操作名称)过滤、干燥。
(5)游泳场馆常用硫酸铜作杀菌剂,这是利用了CuSO4的?_________性质。
4、填空题 硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制 备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3,制备高纯硅的化学反应方程式________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式______________________________;H2还原SiHCl3 过程中若混入O2,可能引起的后果是_________________________________。
(2)下列有关硅材料的说法正确的是____(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅?
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释________。
5、填空题 (三选一)【化学与技术】
随着能源问题的进一步突出,利用热化学循环制氢的研究越发受到发达国家的青睐。最近的研究发现复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢,MnFe2O4的制备流程如下
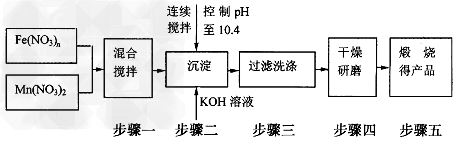
(1)原料Fe(NO3)n中n=____,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为________。
(2)步骤二中“连续搅拌”的目的是______,步骤三中洗涤干净的标准是_____________。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:MnFeO4 MnFe2O4-x+O2↑、MnFe2O4-x+xH2O →MnFe2O4+xH2↑,请认真分析上述两个反应并回答下列问题:
MnFe2O4-x+O2↑、MnFe2O4-x+xH2O →MnFe2O4+xH2↑,请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为________。
②该热化学循环制氢法的优点有(答两点即可)________________。
③该热化学循环制氢法尚有不足之处,进一步改进的方向是_______________。