微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某强氧化剂RO3-中R元素能被还原成较低的价态,如果还原2.4×10-3mol RO3-需要6×10-3mol
Na2SO3(Na2SO3转化成Na2SO4),则反应后R元素的价态是(??)
A.0
B.+1
C.+3
D.+4
参考答案:A
本题解析:根据氧化还原反应中电子的得失守恒可知,RO3-得到的电子是6×10-3mol×2÷2.4×10-3mol =5,所以R在反应后的价态是0价,答案选A。
本题难度:简单
2、选择题 以下为在浓盐酸中H3AsO3与SnCl2反应的离子方程式,关于该反应的说法正确的组合是:(? )??????????
a SnCl2+b Cl-+c H3AsO3+d H+=e As+f SnCl62-+g M?
①氧化剂是H3AsO3;?????????②M为OH-;
③每生成7.5gAs,还原剂失去的电子为0.3?mol;???④ SnCl62-是氧化产物。
A.①③④
B.①②④
C.①②③④
D.只有①③
参考答案:A
本题解析:Sn元素由+2价升至+4价,SnCl62-是氧化产物,而As元素由+3价降至0价,氧化剂是H3AsO3;
由化合价的升降守恒得:3SnCl2+b Cl-+2H3AsO3+d H+=2As+3SnCl62-+g M,再由由电荷守恒及原子守恒可得:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6H2O
故每生成7.5gAs,还原剂SnCl2失去的电子为 本题难度:一般
本题难度:一般
3、填空题 (4分)请配平下列化学方程式:
(1) Fe+ HNO3----- Fe(NO3)3+ NO + H2O
(2) NH3+ O2---- NO + H2O
参考答案:(1)1 、 4 、1、 1 、 2&
本题解析:
试题分析:(1)Fe的化合价升高3价,失去3个电子,N的化合价降低3价,得到3个电子,根据得失电子守恒,则Fe、Fe(NO3)3 的系数是1, NO的系数是1,根据元素守恒,则硝酸的系数是4,H2O的系数是2,检查O元素守恒。
(2)NH3中N元素的化合价是-3价升高到+2价。所以N原子失去5个电子;O2中O元素的化合价从0价降低到-2价,应得到4个电子,根据得失电子守恒,5与4的最小公倍数是20,所以NH3、NO的系数是4,氧气的系数是5,根据元素守恒,H2O的系数是6.
考点:考查化学方程式的配平
本题难度:一般
4、填空题 在有机化学工业中常用的一种钠盐是NaBH4,即硼氢化钠。它具有很强的还原性,也是一种高贮氢密度材料,是最有可能作为氢燃料电池的即时供应氢源。但它不能与水和酸共存。
⑴将其投入水中可生成偏硼酸钠(NaBO2)和氢气,写出该反应的化学方程式 ,反应中的还原剂是 ,每摩NaBH4反应时电子转移数为 mol。
⑵若将NaBH4投入酸溶液中其反应速率与其放入水中相比,应快还是慢 ,理由是 。
⑶NaBH4还用于将含Au3+的碱性废液中回收黄金,其离子方程式为:
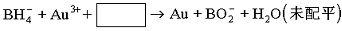
请写出配平的离子方程式 。
参考答案:⑴NaBH4+2H2O=NaBO2+4H2↑ &#
本题解析:略
本题难度:一般
5、填空题 铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式____________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式__________________________________________________。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S 6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式__________________________。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式________________________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3溶液VmL。则试样中CuSO4·5H2O的质量分数为____________。
参考答案:(14分)(1)3Cu+8HNO3(稀)=3Cu(NO3)2
本题解析:
试题分析:(1)硝酸是氧化性酸,能氧化大部分金属,因此铜与稀硝酸反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑。
(2)双氧水具有氧化性,在酸性条件下能被铜氧化成铜离子,而双氧水的还原产物是水,因此溶出铜的离子方程式为Cu+H2O2+2H+=Cu2++2H2O。
(3)根据方程式2Cu2O+ Cu2S 本题难度:困难
本题难度:困难