?
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(2)计算原溶液中Fe2+被氧化的百分率。
(3)当Fe2+部分被氧化时,试推导c(Fe2+、Fe3+)与c(H+)、c(SO42—)的关系。
参考答案:(1)0.1mol/L? 0.6mol/L? 0.5moL/
本题解析:(1)根据pH=1可知,溶液中氢离子浓度是0.1mol/L。28.0g沉淀是硫酸钡,物质的量是0.12mol,浓度是0.12mol÷0.2L=0.6mol/L。8.0g固体是氧化铁,物质的量是0.05mol,所以铁原子的物质的量是0.1mol,因此Fe2+和Fe3+的总的物质的量的浓度是0.1mol÷0.2L=0.5mol/L。
(2)根据电荷守恒进行计算
(3)可以依据极值法进行计算
本题难度:一般
2、填空题 配平下列方程式:
(1)C+H2SO4(浓) CO2↑+SO2↑+H2O______________________ CO2↑+SO2↑+H2O______________________
(2)Cu+ HNO3(稀)→Cu(NO3)2+NO↑+H2O______________________
(3)NH3+O2 NO+H2O______________________ NO+H2O______________________
参考答案:(1)C+2H2SO4(浓)![]() 本题解析: 本题解析:
本题难度:一般
3、选择题 现有等物质的量的铜和银的混合物17.2克,与50.0mL的浓硝酸恰好完全反应,产生气体4.48L(标准状况),则下列说法正确的是
A.产生的气体是0.2molNO2
B.硝酸的物质的量浓度为12mol/L
C.反应中被还原和未被还原的硝酸物质的量之比为3:2
D.要使产生的气体恰好完全被水吸收需要通入氧气0.075mol
参考答案:D
本题解析:根据题意Cu、Ag的物质的量均为0.1 mol,则反应中共失去电子0.3 mol ,HNO3得电子0.3 mol,若生成0.2molNO2,则HNO3得电子0.2 mol,A错误,未被还原的HNO3为0.1 mol×2+0.1 mol×1="0.3" mol,参加反应的HNO3共0.3 mol+4.48L/22.4Lmol-1 ="0.5" mol ,则硝酸的物质的量浓度为10mol/L,B、C错误,根据D项题意HNO3只起到酸的作用,整个反应可看作Cu、Ag与O2反应,生成的氧化物溶于HNO3,即2Cu
本题难度:简单
4、填空题 (13分)某研究性学习小组利用废旧铅蓄电池阴、阳极填充物------铅膏(含PbO、PbO2、PbSO4)制备电绝缘材料三盐基硫酸铅(3PbO?PbSO4?H2O),进行资源回收研究,设计实验流程如下:
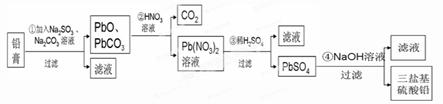
(1)步骤①铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3,说明溶解度:PbSO4 (填“>”或“<”)PbCO3。
(2)步骤①中PbO2转化为PbCO3的离子方程式是(请配平此离子方程式):

(3)将步骤①和④的滤液合并,加入 PH=7,再经过 、冷却结晶、
、洗涤、干燥,可获得Na2SO4?10H2O晶体。
(4)若铅膏的质量为78g,步骤①中PbO2和PbSO4全部转化为PbCO3,且PbO未发生反应;步骤②中共收集到5.6LCO2(标准状态),步骤③中获得90.9 g PbSO4,则铅膏中PbO的质量分数为 (假设流程中原料无损失)。
参考答案:(1)>;(2)1,1,1,1,H2O,1,1,2;(3)H
本题解析:
试题分析:(1)步骤①铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3,说明PbSO4的溶解度大于PbCO3;(2)在步骤①中PbO2转化为PbCO3的反应是氧化还原反应,所以根据电荷守恒、原子守恒可得离子方程式是PbO2+SO32-+CO32-+H2O= PbCO3↓+SO42-+2OH-。(3)将步骤①和④的滤液合并,加入H2SO4调整溶液的酸碱性PH=7,再经过蒸发浓缩;冷却结晶、过滤,洗涤、干燥,可获得Na2SO4?10H2O晶体。(4)若铅膏的质量为78g,步骤①中PbO2和PbSO4全部转化为PbCO3,且PbO未发生反应;步骤②中共收集到5.6LCO2(标准状态),则根据Pb守恒可知PbO2和PbSO4的物质的量是5.6L÷22.4L/mol=0.25mol步骤③中获得90.9 g PbSO4,n(PbSO4)=" 90.9" g÷303g/mol=0.3mol,其中由PbO产生的PbSO4是物质的量是0.3mol-0.25mol=0.05mol则铅膏中PbO的质量分数为(0.05mol×223g/mol÷78g)×100%=14.3%。
考点:考查物质的制取过程中的反应原理的知识。包括物质的溶解度大小的比较、离子方程式的配平、混合物的分离方法、物质纯度的计算等知识。
本题难度:困难
5、选择题 下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为(???)
A.1:3
B.4 :3 :3
C.2:1
D.3:1
参考答案:B
本题解析:略
本题难度:简单
|