微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)="0.1" mol/L,则下列叙述中错误的是(??)
A.反应中消耗的Zn的质量为97.5 g
B.气体A中SO2和H2的体积比为1∶4
C.反应中被还原的元素只有一种
D.反应中共转移电子3 mol
参考答案:C
本题解析:解答本题应注意以下两点:
(1)生成的33.6 L气体可能是SO2和H2的混合气体。
(2)假设反应的Zn一部分还原出SO2,一部分还原出H2,设未知数、列方程式计算。
设气体A中SO2、H2的物质的量分别为x、y。
则根据两个反应方程式可知
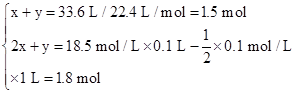
解得x="0.3" mol??
本题难度:一般
2、填空题 (11分)用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方 程式如下:
程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl 2+ 5Cl 2↑+8H2O
5Cl 2↑+8H2O
⑴此反应中氧化剂是????????,氧化产物??????。若有1mol KMnO4参加反应,转移电
子的物质的量为??????????。
⑵15.8g KMnO4完全反应,产生的Cl 2在标准状况下的体积为?????,有??????molHCl
发生反应,有??????molHCl被氧化。
⑶若此盐酸的密度为1.2g/cm3,其物质的量浓度为??????。
参考答案:(11分)
⑴KMnO 本题解析:略
本题解析:略
本题难度:一般
3、填空题 (8分)请将6种物质: N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3 H2O分别填入下面对应的横线上,组成一个配平的化学方程式:方程式为:
(1)?????????+??????????→?????????+ ?????????+ ??????????+???????
(2)反应物中发生氧化反应的物质是??????????????,被还原的元素是???????????????。
(3)反应中1mol氧化剂参加反应时转移电子的物质的量为??????????mol
参考答案:(1) 30HNO3 + 24FeSO4?= 8Fe(NO3
本题解析:(1)硝酸的氧化性强于铁离子的,所以在该反应中,氧化剂是硝酸,还原产物是N2O;还原剂是硫酸亚铁,氧化产物是硝酸铁、硫酸铁,所以方程式为30HNO3 + 24FeSO4?= 8Fe(NO3)3 +? 8Fe2(SO4)3? + 15H2O + 3N2O↑。
(2)发生氧化反应的物质是硫酸亚铁,被还原的元素是氮元素。
(3)氮元素的化合价从+5价降低到+1价,所以根据方程式可知,做为氧化剂的硝酸是参加反应的硝酸的1/5,因此1mol氧化剂发生还原时转移电子是1/5mol×4=0.8mol。
本题难度:一般
4、选择题 氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法不正确的是
A.该反应既是分解反应,又是氧化还原反应
B.变蓝的淀粉碘化钾试纸褪色可能发生的反应:
5C12+I2+6H2O=12H++10Cl—+2IO3—
C.若化学计量数a=8,b=3,则该反应转移电子数为20e—
D.氯酸分解所得O2和Cl2的物质的量之比是确定不变的
参考答案:D
本题解析:O2和HClO4是氧化产物,C12是还原产物,生成HClO4的多少不同会导致反应所得O2和C12的物质的量之比的变化
本题难度:一般
5、选择题 24 mL0.05 mol·L-1的Na2SO3溶液恰好与40 mL 0.02 mol·L-1的K2RO4酸性溶液反应生成硫酸钠,则元素R在还原产物中的价态是( )
A.+6
B.+3
C.+2
D.0
参考答案:B
本题解析:二者的物质的量之比为3:2,其中S元素化合价自+4升至+6,而R在K2RO4中的化合价为+6价,根据化合价升降相等可求得R在还原产物中的价态是+3
本题难度:一般