微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (8分)将6.0 g纯铁粉加入200 mL Fe2(SO4)3和CuSO4的混合液中,充分反应得到200 mL ?0.50 mol·L-1 FeSO4溶液和5.2 g固体沉淀物。计算:
(1)反应后生成铜的质量是多少?
(2)加入铁粉前Fe2(SO4)3溶液的物质的量浓度。
参考答案:2.56 g? 0.1 mol·L-1
本题解析:设Fe2(SO4)3浓度为x mol·L-1。析出Cu为y mol。因为得到200×10-3×0.50="0.1" mol FeSO4,所以6 g Fe过量,Fe剩余,则有:6-(0.2x+y)×56+y×64="5.2?????????" ①
y+0.2x×3="0.2×0.5??????" ???????????????????????????????????????????????②
解得 本题难度:简单
本题难度:简单
2、填空题 铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是????????。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是????????。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃-60℃的两个原因除了加快反应速率外,还有??????????????????。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式????????????????????????。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO, 其猜想可用化学方程式表示为:
Cu +? H2SO4 ????????????????????????????????????????
????????????????????????????????????????
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是???(填字母)
a.Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式?????????????????。若将上述混合物用足量的H2加热还原,所得到固体的质量为????????g。若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为??????????。
参考答案:(1)1.2NA (1分)???
(2)同时防止H2O
本题解析:
试题分析:(1)化合价升高的反应为-2价的S升高至+4价,所以32gCu2S反应电子转移数目为:32g÷160g/mol×6NAmol-1=1.2NA 。
(2)因为H2O2在较高温度时更容易分解,所以温度控制在50℃-60℃,可以防止H2O2分解;根据氧化还原原理,Cu2+把SO32?氧化为SO42?,根据原子守恒,反应物除Cu2+、Cl?、SO32?外,还有H2O,产物还有H+,配平可得离子方程式。
(3)①浓硫酸把铜氧化为CuO,本身被还原为SO2,同时生成水。
②从物质的
本题难度:一般
3、选择题 在冶金工业上,均不能用通常化学还原剂制得的金属组是( )。
A.Na,Mg,Al
B.Na,K,Zn,Fe
C.Zn,Fe,Cu,Ag
D.Mg,Al,Zn,Fe
参考答案:A
本题解析:根据金属的活动性顺序有下列冶炼方法:①从K~Al,用电解法;②Zn~Cu用还原剂(如H2,CO等)还原法;③Hg和Ag用加热分解法2HgO 2Hg+O2↑。
2Hg+O2↑。
本题难度:简单
4、计算题 为测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓HNO3中,将合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的pH=0,假设反应后溶液的体积仍为80mL,试计算:
(1)被还原的HNO3的物质的量。
(2)合金中Ag的质量分数。
参考答案:
 本题解析:本题解题关键在于把握Cu,Ag与浓HNO3反应过程中,隐含了浓HNO3稀释的计算实质,即所涉及的反应有四个:
本题解析:本题解题关键在于把握Cu,Ag与浓HNO3反应过程中,隐含了浓HNO3稀释的计算实质,即所涉及的反应有四个:
Ag+2HNO3(浓)====AgNO3+NO2↑+H2O???????????????????? (1)
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O??????????????? (2)
3Ag+HNO3(稀)====3AgNO3+NO↑+2H2O??????????????????? (3)
3Cu+8HNO3(稀)====3Cu(NO3)2+
本题难度:一般
5、填空题 化学兴趣小组为探究某铁矿石(主要成分为Fe203和Si02)的性质,进行如下实验:
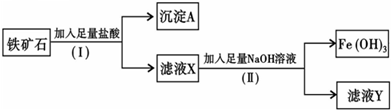
(1)步骤(I)中分离溶液和沉淀的操作名称是______;
(2)沉淀A中一定含有______,该物质属于______(填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈______(填“黄色”或“红色”);
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式______.
参考答案:(1)铁矿石的主要成分为Fe203和Si02,加入足量盐酸后
本题解析:
本题难度:一般