微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g) 2C(g)?ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是(?? )
2C(g)?ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是(?? )
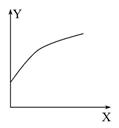
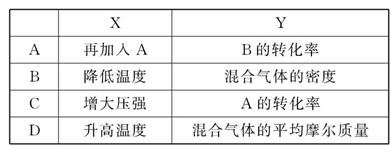
参考答案:D
本题解析:增加A气体的物质的量,平衡向正反应方向移动,B的转化率增大,A对;降低温度,平衡向正反应方向移动,混合气体的体积减小,容器的体积减小,混合气体的总质量不变,混合气体的密度增大,B对;增大压强平衡向正反应方向移动,A的转化率增大,C对;升高温度,平衡向逆反应方向移动,混合气体的总物质的量增大,总质量不变,混合气体的平均摩尔质量减小,D错。
本题难度:一般
2、选择题 下列图示与对应的叙述相符的是

A.由图甲可以判断:若T1>T2,反应A(g)+ B(g) 2C(g)的△H<0
2C(g)的△H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化
参考答案:A
本题解析:
试题分析:A、若T1>T2,温度升高A的转化率降低,说明升高温度平衡逆向移动,则正向是放热反应,△H<0,正确;B、图乙表示是否使用催化剂,因为到达平衡的时间改变而反应物的百分含量不变,说明平衡不移动,所以乙代表使用了催化剂,错误;C、调节溶液的pH=4,溶液呈酸性,若加入氢氧化钠溶液,则溶液呈碱性,铜离子也会沉淀,错误;D、用盐酸滴定氢氧化钠溶液,开始的pH是氢氧化钠溶液的pH值,应大于7,错误,答案选A。
本题难度:一般
3、选择题 FeCl3溶液中滴加KSCN溶液变血红色,是因为发生了下列反应,FeCl3+3KSCN Fe(SCN)3+3KCl,向该平衡体系中加入少量KCl固体,红色将(???)
Fe(SCN)3+3KCl,向该平衡体系中加入少量KCl固体,红色将(???)
A.变浅
B.变深
C.不变
D.无法确定
参考答案:C
本题解析:
试题分析:反应的实质是Fe3++3SCN- Fe(SCN)3,可以看到K+、Cl-没有参加反应,加入少量KCl固体平衡不移动,故选C。
Fe(SCN)3,可以看到K+、Cl-没有参加反应,加入少量KCl固体平衡不移动,故选C。
点评:本题考查的是化学平衡的知识,学生需要注意的是抓住化学反应的本质,是解得本题的关键。
本题难度:简单
4、选择题 在一定条件下,将3 mol N2和3 mol H2充入一个容积固定的密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g)。当反应达到平衡时NH3为n mol。在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合不正确的是(???)
2NH3(g)。当反应达到平衡时NH3为n mol。在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合不正确的是(???)
?
| 起始状态/mol
|
N2
| H2
| NH3
|
A
| 2
| 0
| 2
|
B
| 2.5
| 1.5
| 1
|
C
| 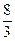
| 2
| 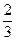
|
D
| 0
| 0
| 2
?
参考答案:D
本题解析:此题为等效平衡问题。根据物质之间的相互转化关系,判断D不可能,因D中只相当于1 mol N2、3 mol H2。
本题难度:一般
5、选择题 一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)  2SCl2(鲜红色液体)DH=-61.16kJ·mol-1。下列说法正确的是 2SCl2(鲜红色液体)DH=-61.16kJ·mol-1。下列说法正确的是
A.单位时间里生成n mol S2Cl2的同时也生成n mol SCl2
B.达到平衡时,若升高温度,压强不变,氯气转化率增大
C.达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n molCl2
D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
参考答案:C
本题解析:所给可逆反应为两边气体系数相等的放热反应,升温,平衡左移,氯气的转化率减小,但气体的总物质的量不变,B错;加入氯气,平衡正移,但其本身的转化率降低,D错;
A:由于不知可逆反应是否为平衡状态,所以单位时间里生成的各物质的量没有定量关系。
C:该选项能表示出正逆反应速率相等,表述正确。
本题难度:简单
|