微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 膦又称磷化氢,化学式为PH3,在常温下是一种无色有大蒜气味的有毒气体,它的分子呈三角锥形,以下关于PH3的叙述中正确的是 ( ? )
A.PH3是非极性分子
B.PH3是一种强氧化剂
C.PH3中有未成键电子对
D.PH3分子中P—H键是非极性键
参考答案:C
本题解析:分子结构是三角锥形,属于极性分子,A不正确。PH3中P的化合价处于最低价,具有强还原性,B不正确。P原子有1对电子没有参与成键,C正确。P和H是不同的非金属,形成的共价键是极性键,D不正确。答案选C。
本题难度:一般
2、选择题 CO(g)与H2O(g)反应过程的能量变化如下图所示,有关两者反应说法正确的是( )

A.该反应为吸热反应
B.CO(g)和H2O(g)所具有的总能量大于CO2(g)和H2(g)具有的总能量
C.反应的热化学方程式:CO(g)+H2O(g)===CO2(g)+H2(g);ΔH=+41kJ·mol-1
D.1mol CO2(g)和1mol H2(g)反应生成1mol CO(g)和H2O(g)要放出41kJ的热量
参考答案:B
本题解析:
试题分析:从图示可知,反应物能量高生成物能量低,所以该反应为放热反应,从反应热为“-”也可知此反应为放热反应,故A错误,B正确;从图示可知,正反应为放热反应,正确的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)??△H=-41kJ/mol,故C、D错误,答案选D。
点评:该题的关键是明确反应热的表示方法、热化学反应方程式的书写,要明确正逆反应的反应热大小相等,符号相反等,有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般
3、填空题 把煤作为燃料可通过下列两种途径:
途径I:直接燃烧:C(s)+O2(g) = CO2(g)
途径II:先制水煤气:C(s) + H2O(g) =" CO(g)" + H2(g)
燃烧水煤气:2 CO(g) + O2(g)=2CO2(g); 2H2(g)+O2(g) = 2H2O(g)
已知:①C(s)+O2(g) = CO2(g);△H1=-393.5kJ·mol-1
②H2(g) + 1/2 O2(g) = H2O(g);△H2=-241.8kJ·mol-1
③CO(g) + 1/2 O2 (g)= CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)C(煤)的标准燃烧热是
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量。
(4)根据两种途径,下列说法错误的是 (单选)
A.途径II制水煤气时增加能耗,故途径II的做法不可取
B.与途径I相比,途径II可以减少对环境的污染
C.与途径I相比,途径II可以提高煤的燃烧效率
D.将煤转化为水煤气后,便于通过管道进行运输
参考答案:(8分)
(1)393.5kJ·mol-1或 △
本题解析:
试题分析:(1)燃烧热是指1mol物质完全燃烧所所放出的热量,故C(煤)的标准燃烧热是393.5kJ·mol-1或 △H =" -" 393.5kJ·mol-1。
(2)①-②-③得煤和气态水生成水煤气的热化学方程式:C(s)+H2O(g) =" CO(g)" + H2(g);△H = +131.3kJ·mol-1。
(3)制水煤气 C(s)+H2O(g)=CO(g)+H2(g);△H2>0,该反应是吸热反应,反应物具有的总能量小于生成物的总能量。
(4)A项:途径II可以提高煤的燃烧效率,故错。故选A。
考点:燃烧热 用盖斯定律进行有关反应热的计算
点评:本题考查学生盖斯定律的应用以及反应吸放热与反应物、生成物能量之间的关系,可以根据所学知识进行回答,难度不大。
本题难度:一般
4、选择题 下列说法正确的是:
A.有机物CH2=CH-CH3中其碳原子杂化类型有sp3和sp2,其中有两个π键,7个σ键
B.分子CO和N2的原子总数相同,价电子总数相等,故性质相似
C.Na+的电子排布式为1s22s22p63s1
D.NO2分子的结构VSEPR模型是直线形
参考答案:B
本题解析:A:CH2=CH-CH3中有8个σ键,1个π键
C:Na+的电子排布式为1s22s22p6
D:NO2分子中心原子上的孤对电子对数为0.5,以1来对待,分子的价层电子对数为3,所以其VSEPR模型是平面三角形,而分子的立体构型为V型。
本题难度:一般
5、填空题 (1) 20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图, 说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
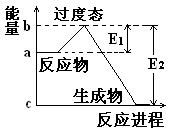
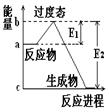
(2)在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应:NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
参考答案:(1) 放热 大于
本题解析:
试题分析:(1)反应物的总能量高于生成物的总能量,因此该反应时放热反应。所以反应物二氧化氮与一氧化碳的总能量大于产物二氧化碳与一氧化氮的总能量。(2)据题意可算出一氧化氮的速率为0.5除以2再除以2等于0.125 mol/Lmin,化学速率之比等于化学计量数之比,而一氧化碳与一氧化氮的化学计量数比为1;1所以,二氧化碳的速率为0.125mol/Lmin 。NO2+CO CO2+NO,2 min生成了0.5摩尔的一氧化氮,则也会生成0.5摩尔的二氧化碳。同时也会消耗0.5摩尔的一氧化碳和二氧化氮。所以剩余的一氧化碳为2减去0.5等于1.5,剩余的二氧化氮为1.5减去0.5等于1摩尔。所以容器内气体的总物质的量为1.5+1+0.5+0.5等于3.5摩尔
CO2+NO,2 min生成了0.5摩尔的一氧化氮,则也会生成0.5摩尔的二氧化碳。同时也会消耗0.5摩尔的一氧化碳和二氧化氮。所以剩余的一氧化碳为2减去0.5等于1.5,剩余的二氧化氮为1.5减去0.5等于1摩尔。所以容器内气体的总物质的量为1.5+1+0.5+0.5等于3.5摩尔
考点:考查化学反应与能量以及化学反应速率的相关知识
本题难度:一般