微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)="4NO" (g) +CO2 (g)+2H2O (g) △H=
参考答案:
本题解析:
本题难度:一般
2、选择题 实验室由MnO2和浓盐酸制取纯净的氯气时,气体通过两个洗气瓶,第二个洗气瓶应盛(???)
A.稀盐酸
B.浓硫酸
C.水
D.饱和食盐水
参考答案:B
本题解析:实验室由MnO2和浓盐酸制取纯净的氯气时,气体通过两个洗气瓶,第一个洗气瓶应盛饱和食盐水,第二个洗气瓶应盛浓硫酸。
本题难度:简单
3、填空题 按要求写出下列方程
(1)碳酸钠溶液呈碱性的原因,用离子方程表示 。
(2)用锌保护海底钢铁设施,其中负极发生的电极反应为: 。
(3)含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式 。
(4)氢氧化镁溶解在浓的氯化铵溶液,用离子方程表示 。
(5) Al(OH)3的电离反应方程式: 。
参考答案:(1)CO32-+H2O 本题解析:
本题解析:
试题分析:(1)碳酸钠是强碱弱酸盐,溶于水电离出的CO32-水解,溶液显碱性,离子方程式为CO32-+H2O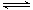 HCO3-+OH-。
HCO3-+OH-。
(2)锌的金属性强于铁,与铁构成原电池时锌是负极失去电子,被氧化。铁是正极,被保护,负极反应式为Zn-2e-=Zn2+。
(3)20.0 g NaOH的物质的量=20.0g÷40.0g/mol=0.5mol,与足量的盐酸反应生成0.5mol水,因此生成1mol水时放出的热量是28.7 kJ×2=57.4kJ。又因为中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol。
(4)氯化铵溶液中NH4+水解溶液显酸性,因此可以溶解氢氧化镁,反应的离子方程式为Mg(OH)2+2NH4+=2NH3·H2O+Mg2+。
(5)氢氧化铝是弱电解质,属于两性氢氧化物存在两种电离平衡,酸式电离和碱式电离,因此其电离方程式为H++AlO2-+H2O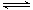 Al(OH)3
Al(OH)3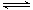 Al3++3OH-。
Al3++3OH-。
考点:考查盐类水解、金属的腐蚀与防护、中和热计算、溶解平衡以及氢氧化铝的电离
本题难度:一般
4、填空题 (12分)(1)用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
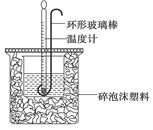
①烧杯间填满碎泡沫塑料的作用是 。
②若大烧杯上改为盖薄铁板,求得的反应热数值: (填“偏大”、“偏小”或“无影响”)
③若通过测定计算产生的热量为1.42kJ,请写该反应的热化学方程式: 。
(2)①已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: 。
②由气态基态原子形成1 mol化学键释放的最低能量叫键能。已知表中所列键能数据, 则
N2(g)+3H2(g) 2NH3(g) ΔH= kJ·mol-1。
2NH3(g) ΔH= kJ·mol-1。
化学键
| H—H
| N—H
| N≡N
|
键能kJ·mol-1
| 436
| 391
| 945
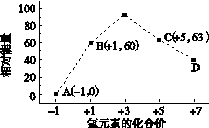
③一定条件下,在水溶液均为1 mol以下离子 Cl-、ClO-、ClO2-、ClO3-、ClO4-的能量(kJ)相对大小如下图所示,则3ClO-(aq)===ClO3-(aq)+2Cl-(aq)的ΔH= kJ·mol-1。
参考答案:(1)①保温(或隔热、或减少热量损失)
本题解析:
试题分析:(1)①中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;②大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会偏小;③由实验可知反应生成0.025moL水时,产生的热量为1.42kJ,则该反应的热化学方程式为HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-56.8kJ·mol-1;
(2)①根据盖斯定律,CH4(g)+2H2O(g)="==" CO2(g)+ 4H2(g)的ΔH=2×(+206.2 kJ·mol-1)-(+247.4 kJ·mol-1)=+165kJ·mol-1,所以CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:CH4(g)+2H2O(g)="==" CO2(g)+ 4H2(g) ΔH=+165kJ·mol-1;②根据ΔH=反应物的总键能-生成物的总键能,得N2(g)+3H2(g) 2NH3(g) ΔH=(945+3×436-2×3×391)kJ/mol=-93kJ/mol;③ClO-(aq)中的Cl元素的化合价是+1价,ClO-(aq)的能量是60,Cl-的化合价是-1价,能量是0,ClO3-中Cl的化合价是+5价,能量是63,根据ΔH=生成物的总能量-反应物的总能量得ΔH=63-3×60=-117kJ/mol。 2NH3(g) ΔH=(945+3×436-2×3×391)kJ/mol=-93kJ/mol;③ClO-(aq)中的Cl元素的化合价是+1价,ClO-(aq)的能量是60,Cl-的化合价是-1价,能量是0,ClO3-中Cl的化合价是+5价,能量是63,根据ΔH=生成物的总能量-反应物的总能量得ΔH=63-3×60=-117kJ/mol。
考点:考查中和热的测定,热化学方程式的书写,盖斯定律的应用。
本题难度:一般
5、填空题 (10分)已知:H2(g)+O2(g)=H2O(g),反应过程中能量变化如图所示:
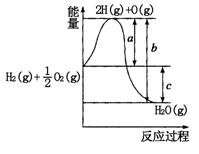
请回答下列问题:
(1)a、b、c分别代表的意义
a. ,
b. ,
c. ;
(2)该反应是 反应(填“放热”或“吸热”),ΔH 0(填“>”、“<”或“=”);
(3)若已知2H2 (g)+O2(g)=2H2O(g) ΔH1=-Q1kJ·mol-1;
2H2 (g)+O2(g)=2H2O(l) ΔH2=-Q2kJ·mol-1,
则ΔH1 ΔH2,Q1 Q2(填“>”“<”或“=”)。
参考答案:(10分)
(1)
a.破坏1molH2和1/2
本题解析:略
本题难度:一般
|