微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)按要求完成以下内容:
(1)Fe2(SO4)3水溶液呈________性,原因是(用离子方程式表示):_________________________;实验室在配制Fe2(SO4)3溶液时,需要加入________来抑制水解。
(2)有三瓶pH均为2的盐酸、硫酸溶液、醋酸溶液。
①设三种溶液的物质的量浓度依次为c1、c2、c3,则它们之间由小到大的顺序为______(用“>”“<”或“=”表示,下同)。
②取同体积的三种酸溶液,分别加入足量锌,反应开始产生H2的速率依次为v1、v2、v3,则它们之间的关系是_____________________;
(3)某温度下,水的离子积常数KW=10-14。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为____________。
参考答案:(1)酸性, Fe3+ + 3H2O
本题解析:
本题难度:一般
2、选择题 下列方程式中,属于水解反应的是
A.H2O+H2O=H3O++OH-
B.HCO3-+OH-=H2O+CO32-
C.CO32-+H2O=HCO3-+OH-
D.HCO3-+H2O=CO32-+H3O+
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列各反应的方程式中,属于水解反应的是: ( )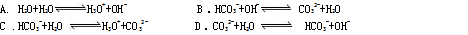
参考答案:D
本题解析:考查盐的水解、水解方程式的书写
A:属于弱电解质水的电离方程式
B :属于碳酸氢盐与碱的离子反应方程式
C:属于电离方程式(两边均去一分水即可)
D:属于水解方程式,选D
本题难度:一般
4、实验题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号
| HA物质的量浓度(mol/L)
| NaOH物质的量浓度(mol/L)
| 混合溶液的pH
|
甲
| 0.2
| 0.2
| pH=a
|
乙
| c
| 0.2
| P H=7
|
丙
| 0.2
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=9
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________ (选填“是”或“否”)。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________。
参考答案:(1) 若a=7,则HA是强酸;若a>
本题解析:
试题分析:(1)不考虑其它组的实验结果,单从甲组情况分析,若a=7,则HA是强酸;若a>7, 则HA是弱酸;(2)不考虑其它组的实验结果,单从乙组情况分析,P H=7,若HA为强,则C等于0.2,若HA为弱酸,则C大于0.2,所以C不一定为0.2;(3)HA物质的量浓度为0.2mol/L,而NaOH物质的量浓度为0.1mol/L,pH>7,所以HA是弱酸,丙组得到的溶液为0.05mol/L的HA和0.05mol/L的NaH的混合液,根据电荷守恒可以得到c(OH-)+c(A-)=c(Na+)+c(H+),由于pH>7,所以c(OH-)>c(H+),即c(Na+) >c(A-),所以混合溶液中离子浓度由大到小的顺序是c(Na+) >c(A-) > c(OH-) > c(H+) ;4)丁组实验所得混合溶液为浓度为0.05mol/L的NaH溶液,其pH为9,所以由水电离出的c(OH-)=10-5mol/L 。
考点:盐类水解,强弱酸,电荷守恒
点评:本题考查了盐类水解,强弱酸,电荷守恒等知识,有一定的综合性,该题的命题方式为高考命题的热点,本题难度适中。
本题难度:一般
5、选择题 在AlCl3和FeCl3的混合液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是( )
A.Fe2S3、I2
B.Al(OH)3、I2
C.Fe(OH)3、Al(OH)3
D.FeS、S、Al(OH)3
参考答案:D
本题解析:
试题分析:氧化性Fe3+ >Al3+,因此加入过量I-,先和Fe3+反应生成Fe2+和I2,再加入S2-,可以和Al3+发生双水解得到硫单质和氢氧化铝沉淀,所以D选项正确。
考点:考查了溶液中离子的氧化还原反应和双水解反应。
本题难度:一般
|