微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁{可表示为Fe2(OH)n(SO4)3-n/2,和绿矾(FeSO4.7H2O)具有成本低、反应快、产品质量高等优点。制备流程如下图:
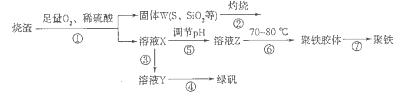
(1)流程图中溶液X为Fe(SO4)3,溶液,据此写出操作①中属于氧化还原反应的离子方程式:____________。
(2)操作②的处理存在弊端,该弊端是_____________。若固体W与KOH溶液昆合加热,其中一个反应的化学方程式为3S+6KOH 2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
(3)操作③需要加入的物质(试剂)是_________,目的是___________________________。
(4)操作⑤是使溶液pH___________(填“增大”或“减小”)。
(5)操作⑥控制温度为70 -80℃的目的是_________________________________________ 。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2,反应的化学方程式为__________________________________。
参考答案:(1)4FeS+3O2+12H+=4Fe3++6H2O+4S
本题解析:
试题分析:(1)氧化还原反应的特征是元素的化合价的升降。发生的反应中属于氧化还原反应的为:4FeS+3O2+12H+=4Fe3++6H2O+4S。
(2)在固体W中含有S、SiO2,在灼烧时S被氧化为SO2而逸出,导致环境污染。在反应3S+6KOH 2K2S+K2SO3+3H2O中,S既作氧化剂,也
2K2S+K2SO3+3H2O中,S既作氧化剂,也
本题难度:一般
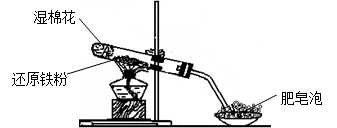
2、实验题 某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为____________________________________。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许固体物质于试管中,并向试管中加稀硫酸得溶液B;
②取少量溶液B于试管中,滴加几滴KSCN溶液,结果溶液未变红色,说明硬质试管中固体物质的成分有:____________________________。(填化学式)
(3)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图
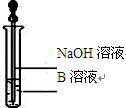
所示的操作,可观察到先生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式:
①?????????????????????????????????????????????????????????????????????;
②?????????????????????????????????????????????????????????????????????。
(4)一段时间后,该同学发现(2)中未变红的溶液变成红色,说明Fe2+ 具有?????????性。由此可知,实验室中FeSO4溶液要临时配制并加少量铁粉的原因是??????????。(用离子方程式表示)
参考答案:(1)3Fe+4H2O(g) 本题解析:
本题解析:
试题分析:(1)本题为铁与水蒸汽的反应实验,硬质试管中发生反应的化学方程式为:
3Fe+4H2O(g) Fe3O4+4H2,(2)滴加几滴KSCN溶液,结果溶液未变红色,说明该溶液中并没有铁离子,说明铁离子被铁还原为亚铁离子,所以固体物质的成分为Fe3O4和Fe;(3)B溶液中含有亚铁离子,所以加入
Fe3O4+4H2,(2)滴加几滴KSCN溶液,结果溶液未变红色,说明该溶液中并没有铁离子,说明铁离子被铁还原为亚铁离子,所以固体物质的成分为Fe3O4和Fe;(3)B溶液中含有亚铁离子,所以加入
本题难度:一般
3、填空题 (12分)利用染化厂的废料铁泥(主要成分是Fe2O3、FeO和铁)制备可用于隐形飞机涂层的纳米四氧化三铁的生产流程为:
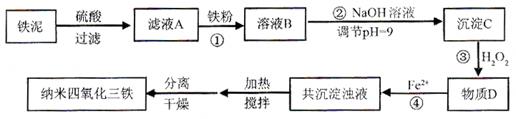
请回答:
(1)过程①主要反应的离子方程式为????????????????????。
(2)已知氢氧化亚铁的Ksp=4.87×10-17,氢氧化铁的Ksp=2.6×10-39。
当溶液中某离子浓度不高于1×10-5 mol·L-1时,可以认为该离子已经完全沉淀。通过计算所得数据说明过程②调节pH=9的原因是??????????????????。
(3)物质D的主要产物中铁、氢、氧三种元素的质量比为56∶1∶32,则过程③主要反应的化学方程式为????????。
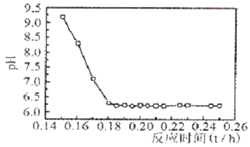
(4)已知Fe2+在弱碱性溶液中还原性较强,图11是研究过程④的实验所得,则该反应所需的时间控制在????小时左右,较为适宜。
(5)某工厂处理废铁泥(测得铁元素含量为16.8 %)的能力为10吨/小时,生产纳米四氧化三铁的产量为4.64吨/小时。如不考虑过程④以后生产中Fe2+的氧化,则该工厂每小时消耗铁粉的质量为??????????千克。
参考答案:(1)2Fe3+ + Fe = 3Fe2+??(2分)??(
本题解析:(1)滤液A中含有铁离子,所以方程式为2Fe3+ + Fe = 3Fe2+。
(2)根据氢氧化亚铁的溶度积常数可知,当pH=9时,c(Fe2+)=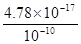 4.87×10-7mol·L—1,此时已经完全沉淀。
4.87×10-7mol·L—1,此时已经完全沉淀。
(3)铁、氢、氧三种元素的质量比为56∶1∶32,则原子个数之比时1︰1︰2,即化学式为FeO(OH
本题难度:一般
4、选择题 铁是一种应用广泛的金属。下列有关铁的说法正确的是
A.铁与盐酸反应生成氯化铁和氢气
B.常温下铁在浓硫酸中钝化
C.铁在氧气中燃烧生成物为三氧化二铁
D.纯铁(块状)是黑色金属
参考答案:B
本题解析:
试题分析:.铁与盐酸反应生成氯化亚铁和氢气,A不正确;B正确,C不正确,铁在氧气中燃烧生成四氧化三铁。纯铁是银白色金属,D不正确,答案选B。
点评:该题是识记性知识的考查,难度不大。平时注意知识的积累和总结,并能灵活运用即可,有利于巩固基础,通过学生的应试能力。
本题难度:一般
5、选择题 下列物质的名称和化学式不相符的是
A.赤铁矿(Fe2O3)
B.硫铁矿(FeS2)
C.铁红(Fe2O3)
D.磁铁矿(FeO)
参考答案:D
本题解析:略
本题难度:简单