微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (7分)已知Cu和HNO3可以发生如下反应:
Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑+ 2H2O、3Cu + 8HNO3(稀)="3" Cu(NO3)2 + 2NO↑+ 4H2O
已知22.4g铜与140mL一定浓度的硝酸恰好完全反应,产生的NO和NO2混合气体在标准状况下的体积为11.2L。试求:
(1)标准状况下NO和NO2的体积分别是多少?
(2)待产生的气体全部释放后,向溶液中加入2mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,所需NaOH溶液的体积是多少?
2、选择题 为了检验FeCl2溶液是否氧化变质,可向溶液中加入的试剂是(????)
A.盐酸
B.KSCN溶液
C.氯水
D.石蕊溶液
3、选择题 根据以下叙述制备氯化铜:先将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解。已知:FeS不溶于水,但溶于酸。
溶液中被沉淀离子
| Fe3+
| Fe2+
| Cu2+
|
完全生成氢氧化物沉淀时,溶液的pH
| ≥3.7
| ≥9.6
| ≥6.4
?
在除去溶液中的Fe2+时,可采用的方法是( )
A.可直接加碱,调整溶液的pH≥9.6
B.加入纯铜粉,将Fe2+还原为Fe
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3~4
D.通入H2S使Fe2+直接沉淀
4、填空题 工业生产无铁硫酸铝,以硫酸浸取铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)得含铁(Fe3+)的硫酸铝溶液,加热到一定温度,搅拌,加入一定量高锰酸钾溶液和硫酸锰溶液,在溶液中生成活性二氧化锰,调节溶液的pH,反应一段时间,二氧化锰和Fe?(OH)?3发生吸附共沉作用,最终得到无铁硫酸铝产品.
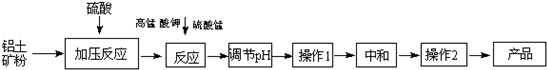
(1)硫酸浸取铝土矿时主要反应的离子方程式为______;
(2)完成高锰酸钾溶液和硫酸锰溶液反应的化学方程式:2KMnO4+3MnSO4+2H2O=______;
(3)调节pH的作用是______;
(4)操作1的名称为______,实验室进行操作2用到的陶瓷质仪器有______;
(5)下列有关工艺的说法正确的是______(双选,填字母).
A.可以向溶液中再加入铝土矿粉等调节pH
B.溶液的碱性越强,则除铁效果越好,而且不会影响硫酸铝的产率
C.活性二氧化锰生成量应适宜,不足时铁的去除率较低,过量时会增加成本
D.可以直接向溶液中加入二氧化锰粉末以除去Fe?(OH)?3.
5、实验题 为测定 FeO 和 Fe2O3 固体混合物中 Fe元素的含量,可用氢气还原一定质量的此混合物并测定生成水的质量的方法来完成。若在实验室中选用下列实验装置来实现上述目的(图中夹持装置已略去,部分装置可重复使用)。请填空:
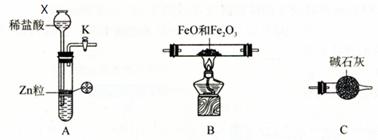
⑴仪器X的名称是????????????????????。
⑵写出A中发生反应的离子方程式??????????????????????????????????????,
实验前如何检验装置A的气密性??????????????????????????????????????。
⑶下图所示装置中与A装置具有相同作用的是??????????????(填装置编号)。
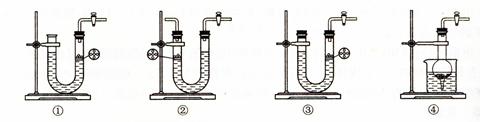
⑷按正确的实验设计,所连接的装置顺序为:A→C→?????→?????→??????。
⑸若FeO和Fe2O3混合物的质量为 ag,反应完全后生成水的质量为 b g,则混合物中Fe元素的质量分数为?????????????????(用含字母的数学式表示)。
|