微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 常温下,将0.01 mol NH4Cl和 0.002 mol NaOH 溶于水配成1 L混合溶液,
!)该溶液中存在的三个平衡体系是:______________________________、
_______________________________、_______________________________。
溶液中共有_______种不同的粒子。
这些粒子中浓度为0.01 mol/L 的是_________,浓度为0.002 mol/L 的是_________。
(4)物质的量之和为0.01 mol的两种粒子是:___________和______________。
(5)_______和_______ 两种离子数量之和比OH-多0.008mol。
参考答案:(1) ?NH3·H2O  本题解析:略
本题解析:略
本题难度:简单
2、选择题 通常情况下氧气的密度是1.28 g/L,在实验室中利用KClO3制氧气,生成氧气的平均速率为0. 01
mol/(L·min),现要制取500 mL氧气,需要的时间为[???? ]
A.1 min
B.2 min
C.3 min
D.4 min
参考答案:D
本题解析:
本题难度:来源:91考试网 91exam.org简单
3、选择题 T°C时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
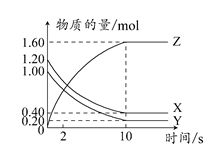
下列描述正确的是????????????? ( )
A.平衡时,X、Y的转化率相同
B.达到平衡后,将容器体积压缩为1 L,平衡向正反应方向移动
C.T°C时,该反应的化学方程式为:X(g)+Y(g) 2Z(g),平衡常数K=40
2Z(g),平衡常数K=40
D.T°C时,若起始时X为0.71 mol,Y为1.00 mol,则平衡时Y的转化率约为60%
参考答案:D
本题解析:根据图示,X、Y为反应物,Z为生成物,10 s时达到平衡。在0~10 s内,Z增加1.60 mol,X减少0.80 mol,Y减少0.80 mol,由于X、Y起始物质的量不同,故平衡时X、Y的转化率不同,A项不正确;根据Δn(X):Δn(Y):Δn(Z)=0.80 mol:0.80 mol:1.60 mol=1:1:2,得T°C时,该反应的化学方程式为:X(g)+Y(g) 2Z(g),由于反应前后气体体积不变,达到平衡后,将容器体积压缩为1 L,平衡不移动,B项不正确;达到平衡时,c(X)=0.40 mol/2 L=0.20 mol/L,c(Y)=0.20 mol/2 L=0.10 mol/L,c(Z)=1.60 mol/2 L=0.80 mol/L,平衡常数K=
2Z(g),由于反应前后气体体积不变,达到平衡后,将容器体积压缩为1 L,平衡不移动,B项不正确;达到平衡时,c(X)=0.40 mol/2 L=0.20 mol/L,c(Y)=0.20 mol/2 L=0.10 mol/L,c(Z)=1.60 mol/2 L=0.80 mol/L,平衡常数K= =32,C项不正确;若起始时X为0.71 mol,Y为1.00 mol,则:
=32,C项不正确;若起始时X为0.71 mol,Y为1.00 mol,则:
X(g) + Y(g)  2Z(g)
2Z(g)
起始(mol)? 0.71??????1.00 ??????0
改变(mol)? x ??????????x ???????2x
平衡(mol)? 0.71-x? 1.00-x? 2x
由于温度不变,K不变,故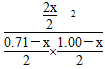 =32,解得x=0.60,故平衡时Y的转化率为60%。
=32,解得x=0.60,故平衡时Y的转化率为60%。
本题难度:一般
4、选择题 在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g)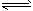 4C(g) +5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是[???? ]
4C(g) +5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是[???? ]
A.0.45 mol / (L·s)
B.0.15 mol / (L·s)
C.0.225 mol / (L·s)
D.0.9 mol / (L·s)
参考答案:C
本题解析:
本题难度:简单
5、选择题 反应A(g)+3B(g)?2C(g)+2D(g),在四种不同条件下的反应速率如下,其中表示反应最快的是( ? )
A.vA=0.15mol/(L?min)
B.vB=0.6mol/(L?s)
C.vC=0.2mol/(L?min)
D.vD=0.01mol/(L?s)
参考答案:B
本题解析:
本题难度:一般